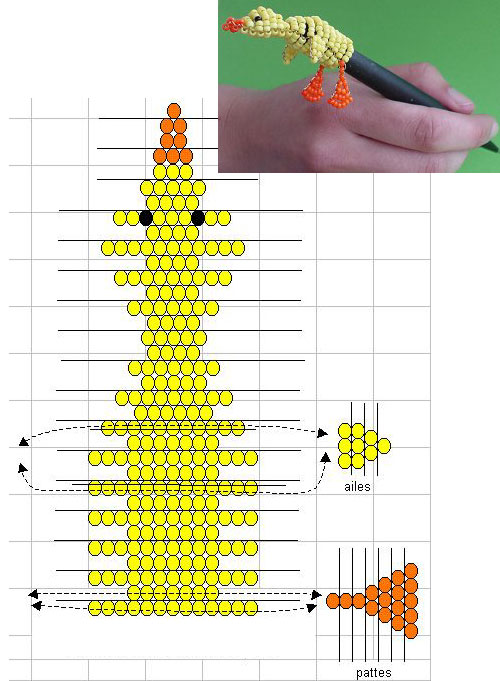
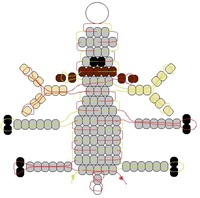
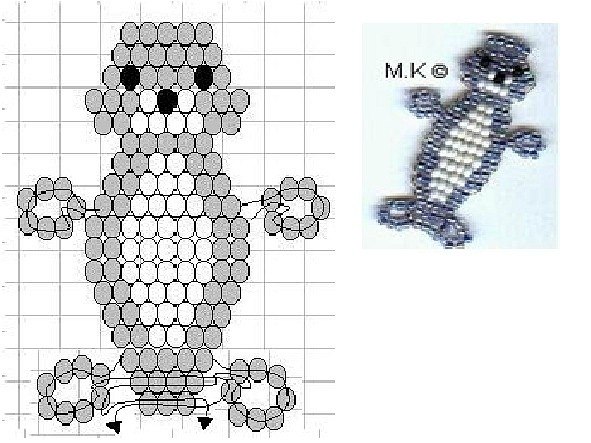
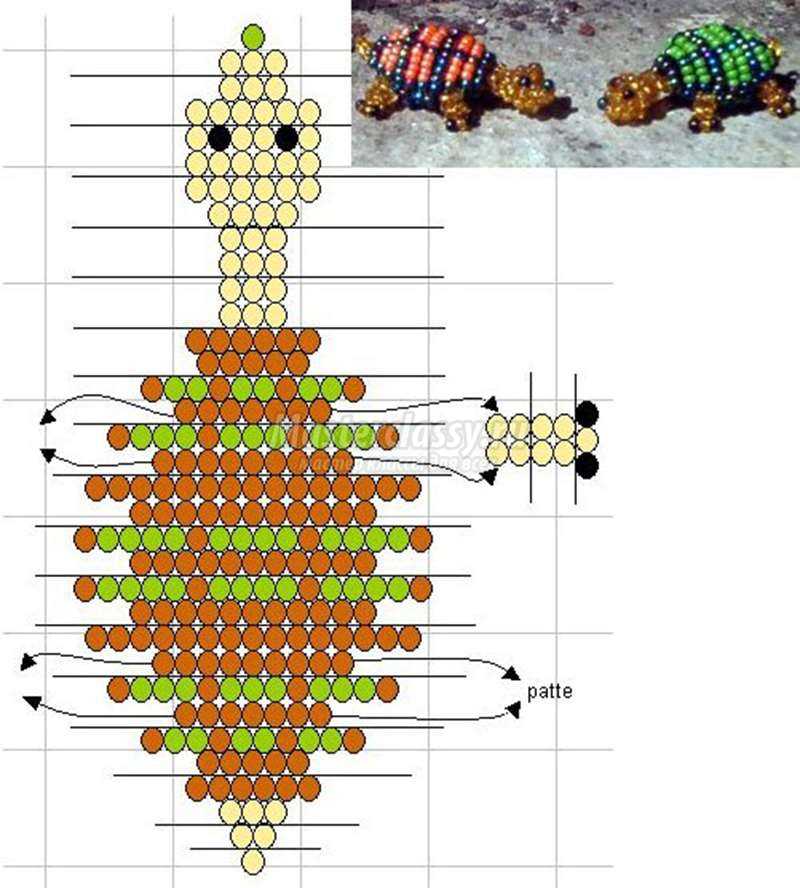
Категория: Животные и птицы из бисера
by biserok.org 01 мая, 2013 Дракон, Медведи, Сложно, Фуллерен
Белые медведи из бисера в костюмах По всей видимости эти милые медвежата собрались на карнавал. Переодевшись в усатых драконов, их стало почти не отличить от этих величественных и мифических животных! Конечно же это я все в шутку. Однако, если вы любите плести маленькие игрушки из бисера, то эта …
Читать дальше → Три схемы плетения объемных рыб из бисера
В каждой работе используется параллельная техника плетения на проволоки или на леске.
by biserok.org 22 апреля, 2013 Морской конек, Оплетение бусин, Средняя сложность
 Такие брелоки хорошо поднимают настроение, по этому стоит порадовать себя такой приятной мелочью из бисера и бусин.
Необходимые материалы для работы:
— … Читать дальше →
Такие брелоки хорошо поднимают настроение, по этому стоит порадовать себя такой приятной мелочью из бисера и бусин.
Необходимые материалы для работы:
— … Читать дальше →by biserok.org 29 марта, 2013 Дракон, Мозаичное плетение, Ндебеле, Сложно
Беззубик. Мастер-класс плетения Ночной Фурии
Необходимые материалы:
— леска (0,10)
— бисер японский №15
— бисер того же цвета №10 или №8
— 2 граненые бусины для глаз
— стеклярус для когтей
На работу ушло примерно 10 часов
1. Плетем голову.
Наберите 44 бисерины и замкните в кольцо. …
Мастер-класс плетения Ночной Фурии
Необходимые материалы:
— леска (0,10)
— бисер японский №15
— бисер того же цвета №10 или №8
— 2 граненые бусины для глаз
— стеклярус для когтей
На работу ушло примерно 10 часов
1. Плетем голову.
Наберите 44 бисерины и замкните в кольцо. …
Все знают эту милую и такую популярную белую кошечку.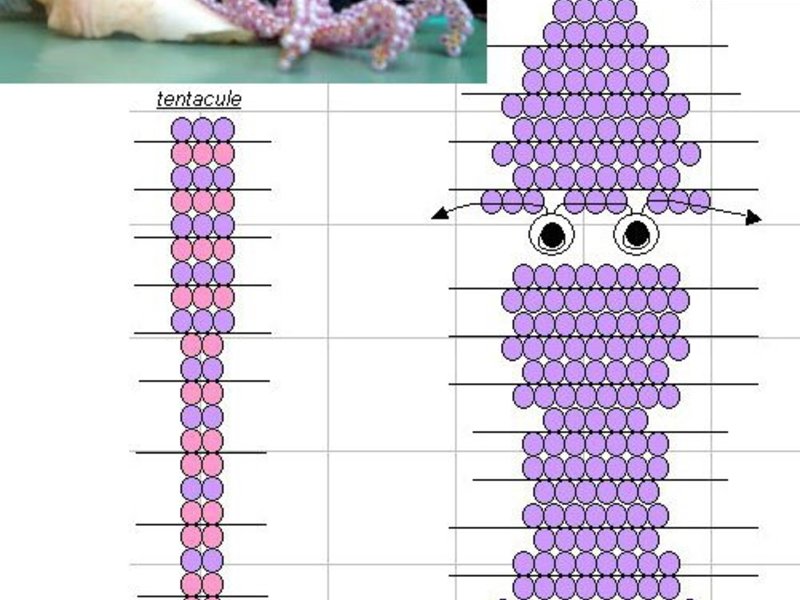 У нас увлечение Китти у моей малой началось с того, что Святой Николай подарил ей мягкую игрушку Hello Kitty в прошлом году. Потом последовали расскраски и всяческие наклейки, ну, и т.д.
Порывшись в интернете я нашла несколько схем для …
У нас увлечение Китти у моей малой началось с того, что Святой Николай подарил ей мягкую игрушку Hello Kitty в прошлом году. Потом последовали расскраски и всяческие наклейки, ну, и т.д.
Порывшись в интернете я нашла несколько схем для …
by biserok.org 05 декабря, 2012 Белый, Лебедь, Параллельное плетение, Просто
Объемные лебеди из бисера
Лебедь является одним из самых величественных, красивых и грациозных разновидностей птиц.
by biserok.org 04 декабря, 2012 Дельфин, Краб, Параллельное плетение, Просто, Русалка, Рыбка
Плоские фигурки рыбок, русалок и других морских жителей Если вам нравится плести из бисера маленькие фигурки различных животных, то эти схемы обязательно придутся вам по вкусу! Можно заселить целый аквариум, или украсить подвесками люстру, пришить рыбку к сумке, кофте или куда вам будет угодно.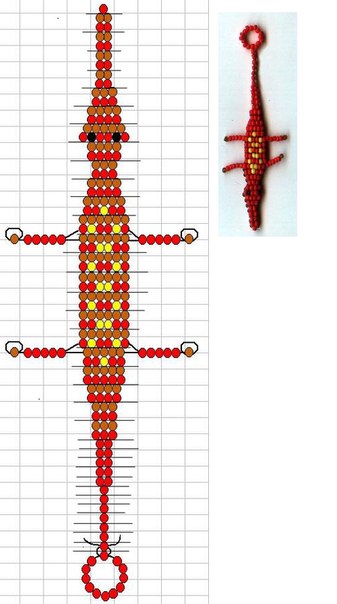 … Читать дальше →
… Читать дальше →by biserok.org 28 ноября, 2012 Коричневый, Параллельное плетение, Просто, Птицы, Сова, Средняя сложность
Подборка совят
В этой статье я решила собрать для вас всевозможные схемы сов из бисера. Все примеры были найдены на просторах интернета. Начнем с самых простых.
Плоские фигурки
Как вы заметили, схемы есть не для всех сов, но они и не нужны, так как работы можно выполнить и по готовым …
Начнем с самых простых.
Плоские фигурки
Как вы заметили, схемы есть не для всех сов, но они и не нужны, так как работы можно выполнить и по готовым …
Подборка зеленых лягушат из бисера и бусин
Схема 1. Маленький лягушонок
Необходимый материал для плетения лягушонка:
К схеме не было понятного описания, а только японские иероглифы, так что придется разбираться по рисункам и изображениям.
Основная техника, используемая в этом …
Маленький лягушонок
Необходимый материал для плетения лягушонка:
К схеме не было понятного описания, а только японские иероглифы, так что придется разбираться по рисункам и изображениям.
Основная техника, используемая в этом …
by biserok.org 04 ноября, 2012 Заяц, Кирпичный стежок, Кошка, Оранжевый, Просто, Серый
Милая парочка кот и заяц
Это очень удачная подвеска или аксессуар, который можно подвесить к сумке, рюкзаку или просто повесить в комнате для поднятия настроения. Такие теплые объятия могут вызывать только положительные чувства у окружающих.
Необходимый материал:
— чешский бисер №10-12 …
Такие теплые объятия могут вызывать только положительные чувства у окружающих.
Необходимый материал:
— чешский бисер №10-12 …
мастер класс как делать объемные поделки
Фигурки из бисера, которые отлично подойдут для начинающих рукодельниц, получили большое распространение и популярность уже достаточно давно. Изготовленные своими руками при помощи разноцветного и блестящего бисерного материала фигурки и композиции украшают своим видом интерьер и предметы одежды.
В нашей статье мы подробно и доступно опишем несколько техник плетения из бисера разнообразных фигурок и композиций для детей и взрослых. При помощи сплетенных фигурок можно украсить аксессуары, брелки и прочие вещи.
Плетем простые фигурки из бисера для начинающих рукодельниц
Принято считать, что плетением из бисерного материала чаще всего занимаются дети или девочки подросткового возраста. Однако на самом деле этот вид прикладного творчества давно покорил всю мировую элиту. Если не верите, то можете найти в интернете множество подтверждающих фотографий, на которых известные киноактрисы разгуливают в украшениях из бисера. Но сегодня мы расскажем вам не о том, как делаются серьги или колье, а научим создавать миниатюрные копии животных. Прежде всего, для плетения фигурок из бисера вам понадобится схема, и ее вариантов на самом-то деле не так уж и много. Первый вариант – поперечное плетение, второй – работа по кругу. Начинающим лучше остановить свой выбор на фигурках из бисера со схемами параллельного плетения, а вот продвинутым пользователям можно научиться создавать объемных животных.
Однако на самом деле этот вид прикладного творчества давно покорил всю мировую элиту. Если не верите, то можете найти в интернете множество подтверждающих фотографий, на которых известные киноактрисы разгуливают в украшениях из бисера. Но сегодня мы расскажем вам не о том, как делаются серьги или колье, а научим создавать миниатюрные копии животных. Прежде всего, для плетения фигурок из бисера вам понадобится схема, и ее вариантов на самом-то деле не так уж и много. Первый вариант – поперечное плетение, второй – работа по кругу. Начинающим лучше остановить свой выбор на фигурках из бисера со схемами параллельного плетения, а вот продвинутым пользователям можно научиться создавать объемных животных.
При помощи техники параллельного плетения можно создать фигурки животных из бисера. Представленная техника переплетения бисера между собой совершенно несложная. Для работы по такому принципу следует помнить один основной акцент и вариант исполнения рядов из бисерного материала и лески: ряды бисера в схеме плетения делятся на переднюю часть и заднюю. Это значит, что под каждым направлением горизонтали располагается над верхней частью, а под ними находится нижняя часть. Полосы бисера по схеме располагаются через каждые две линии: полоска, верхний рядок, нижний рядок, полоска и так далее соблюдайте описанную выше последовательность действий.
Это значит, что под каждым направлением горизонтали располагается над верхней частью, а под ними находится нижняя часть. Полосы бисера по схеме располагаются через каждые две линии: полоска, верхний рядок, нижний рядок, полоска и так далее соблюдайте описанную выше последовательность действий.
Изучаем дельфина из бисера своими руками в технике параллельного плетения
Предлагаем вам подробный мастер-класс по плетению фигурки дельфина своими руками при помощи бисера и проволоки. Для работы вам потребуется подготовить следующий материал и инструментарий:
- Бисер среднего диаметра разных цветов: голубой, белый, черный оттенки.
- Моток проволоки.
После подготовки всего необходимого материала можете приступать к процессу изготовления объёмной фигурки дельфина из бисера.
По схеме плетения необходимо расположить бисеринки голубого цвета вверху, а бисеринки белого цвета должны располагаться снизу. Плетение бисера для фигурки дельфина необходимо начинать с носика животного и проводить по рядам.
- Первый и второй ряды необходимо плести по аналогии друг с другом. Расположите пару голубых бусинок и одну белую бисеринку.
- Третий ряд сплетите из пяти голубых бисерин и пары белых бусин.
- В четвертом ряду расположите семь голубых и три белых бисерины.
- В пятом ряду поместите девять голубых бисерин и четыре белых бусины.
- В шестом ряду расположите голубую бусинку, черную бисерину, семь бисерин голубого цвета, черную, голубую и пять белых бисерин.
- В седьмом и восьмом ряду поместите одиннадцать бисеринок голубого цвета, и пять бусин белого.
- Девятый, десятый и одиннадцатый рядочки содержат в себе десять голубых и четыре белых бисеринки.
- Двенадцатый ряд включает в себя десять голубых и три белых бусинки.
- В тринадцатом ряду располагаются восемь бисерин голубого цвета и пара белых.
- Четырнадцатый ряд: шесть голубых бусинок и одна белая.
- Последний, пятнадцатый, ряд содержит пять голубых бисеринок и одну бусинку белого оттенка.

- Далее сформируйте плоский хвост (не двойными рядами, а только одним), по следующей схеме: два-три-пять. Далее концы проволочки расходятся в разные стороны и завершают тремя бисеринами, выстроенными треугольником, всю работу.
- Плавники делаются так же, как и хвост, но по схеме: один-два-два. Вставляйте концы проволоки в седьмой и восьмой ряды белого цвета, пропустите их через все бисерины и второй плавник сделайте в зеркальном отражении: два-два-один. Проволоку необходимо закрепить.
После завершения всех описанных манипуляций и действий ваш дельфин из бисера готов.
Подборка тематического видео к статье
Предлагаем вашему вниманию подборку тематического видео по материалу статьи. В представленной подборке вы найдете всю необходимую подробную и наглядную информацию о процессе создания фигурок своими руками из бисера.
youtube.com/embed/tqCwCXzemLk?feature=oembed» frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>
Бисероплетение для самых-самых начинающих: Животные из бисера
Волк
Подробный мастер-класс — здесь
Дикобраз
Дракон
Дракончик
Ёжик
Жираф
Заяц
Змея
Змея объёмная
Золотая рыбка
Какаду
Кит
Коза (вариант плетения на леске)
Коза (вариант плетения на проволоке)
Колибри
Кошка
Кот
Краб
Крокодил
Крыса
Курица
Лебедь
Лев
Леопард
Лиса
Лошадка плоская
Лошадь объёмная
Лягушка
Медвежонок
Медведь
Медуза
Мопс
Мышонок — магнит на холодильник
Немецкая овчарка
Овечка
Обезьянка объёмная
Обезьянка плоская
Ослик
Павлин
Паук
Петух
Пингвин
Пудель
Свинка
Северный олень
Скорпион
Слонёнок
Слоник — магнит на холодильник
Снегирь
Собака
Собачка
Сова
Стрекоза
Такса
Тюлень
Цыплёнок
Черепаха
Шиншилла
Поделки из бисера для начинающих ? как сделать руками, фото
Основным лидером рукодельного мастерства можно назвать технику бисероплетения.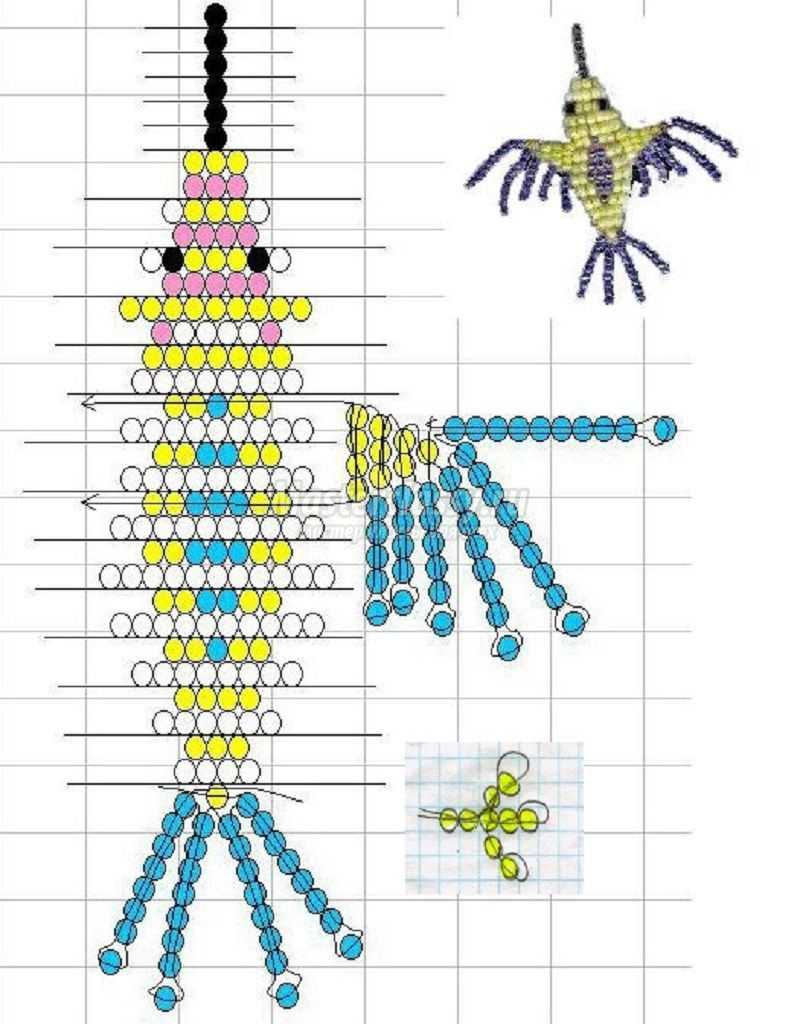 Широкое использование материала нашло применение в изготовлении игрушек, украшений, элементов декора, брелоков со схемами. Особой популярностью обладают фигурки из бисера.
Широкое использование материала нашло применение в изготовлении игрушек, украшений, элементов декора, брелоков со схемами. Особой популярностью обладают фигурки из бисера.
Основным лидером рукодельного мастерства можно назвать технику бисероплетения
Содержание материала
Фигурки из бисера: идеи для начинающих
Бисерные фигурки – самый простой способ научиться азам бисеропления. Искусство владения вязальным крючком в сочетании с техникой бисерного переплетения пригодится при создании авторских шедевров украшений, браслетов-жгутиков или оригинальных поделок-застежек для прически или броши. Развивая творческую идею бисерных изделий, предложите своему малышу смастерить героев его любимой сказки для последующего семейного театрализованного представления.
Декоративное панно из фигурок – отличный сувенирный подарок на день рождения. А букетик бисерных цветов – оригинальное и недорогое дополнение к домашнему интерьеру. Яркие игрушки – бабочки, куколки, животные могут быть хорошим украшением рабочего места, или эффектной подвеской к телефону, школьному рюкзаку.
Галерея: картинки фигурки из бисера своими руками (25 фото)
Объемная лисичка из бисера: мастер-класс (видео)
Маленькие секреты для тех, кто хочет стать мастером бисероплетения.
Для создания удивительных авторских вещей начинающим рукодельницам лучше взять крупный бисер. Это поможет быстрее овладеть техникой плетения по схематичным изображениям образа. Более опытным рекомендуется пользоваться исходным материалом чешского или японского производителя, поскольку такой бисер отличается качественным покрытием, соблюдением одинакового оттенка расцветки, точным размером поштучных бисеринок.
В начале работы используйте тонкую проволоку для рукоделия, материал удобный для фиксирования простейших узлов. При сложном плетении можно применить леску или капроновую нить.
Для создания удивительных авторских вещей начинающим рукодельницам лучше взять крупный бисер
Создавая шедевры по собственным схемам, перенесите понравившееся изображение через копирку на бумагу. Затем произвольным порядком в рамках образа рисуйте расположение бисера, закрасив их желаемым цветовым оттенком. Таким образом можно создавать схематические изображения более сложных конструкций – картин, панно. Для фиксирования плоских фигурок из бисера на поверхности будущего объемного изображения – картины применяйте клей ПВА.
Как сделать объемную фигурку или человечка из бисера своими руками: учимся плести зайца
Как сплести маленькую объемную игрушку для ребенка? Очень просто. Капелька терпения, точное следование инструкциям и поделка собственными руками удачно заменит малышу дорогую магазинную игрушку. Вовлекайте в процесс ребенка – совместное занятие рукоделием развивает цветовое восприятие, тренирует моторику маленьких пальчиков, обучает четкому пониманию различий между создаваемыми образами.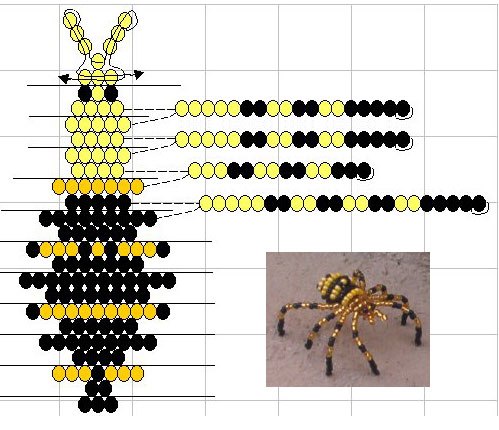 Работая над бисерными игрушками, можно создать собственный кукольный театр.
Работая над бисерными игрушками, можно создать собственный кукольный театр.
Необходимо:
- Бисеринки белого цвета
- Бисер черного цвета 2 шт.;
- Бисер розового цвета 1 шт.;
- Тонкая проволока около 1 метра, леска.
Работая над бисерными игрушками, можно создать собственный кукольный театр
Как делать:
- Нанизать одну розовую бисеринку, затем еще две белые. Протянуть через белые с обеих сторон проволоку. Получается два ряда, один сверху розовый, снизу белый. Стянуть.
- Следующие пять белых бисерин поместить поверх двух белых, стянуть оба конца, продев проволоку через стороны.
- Четвертый нижний ряд набрать три белых бусинки, протянуть через них вторую сторону проволоки, стянуть.
- Формируем глазки путем размещения на следующем верхнем плетении две белых, черную, две белых, черную, обратно две белых бусины. Ряд делаем верхним слоем. Вниз четыре белых. В каждом уровне плетения обязательно протягивать проволоку через материал с обеих сторон для укрепления объема поделки.

- Далее используем только белые: верх – десять, низ – три бусинки.
- Пятый ряд: вверху девять, затем в ряд протянуть два добавочных отрезка проволоки примерно по 20 см длиной для ушек. Дополнительные отрезки тянем через третьи бусинки справа и слева. Низ закрепить двумя белыми.
- Шестой ряд формируем обе стороны по шесть штук бисерин.
- Следующий рядок – верх пять, низ – восемь. На данном этапе уже видна сформированная голова зайца.
- Начинаем туловище – вверху пять, внизу десять бисеринок. Здесь добавляем обратно два одинаковых отрезка проволоки для лапок, стягиваем.
- Последующие два ряда одинаковые – верхний по шесть, нижний по двенадцать бусин. Затем уменьшаем: сверху пять, снизу одиннадцать, обратно протянуть проволоку для формирования лапок.
- Далее по три – восемь один ряд и две – четыре следующий. Хвостик из двух верхних бусин плюс одна сверху них. Оставшуюся свободную проволоку скрутить, зафиксировать концы.
- Ушки зайчика плести по схеме: 1-3, 2-4,3-3, 4-2.
- Лапки передние: 1-2, 2-2, 3-1.
- Лапки задние делаем так же, в третьем ряду снизу добавить одну бусину.
Для придания устойчивости созданной фигуре прошиваем ее леской.
Простая фигурка из бисера – кукла
Понадобится:
- Бусина жемчужного цвета 7 мм – 1 шт.;
- Тонкая проволока длиной 70 см, 10 см;
- Бисер белый, красный, коричневый.
Куклы могут быть самыми разными
Что делать:
- Набрать семь бисерин, поместить их на середину проволоки, концы протянуть через жемчужную бусину с обеих сторон крестом.
- Косичку волос куклы плетем из шести коричневых бисерин, затем формируем бант – набрать четыре красных, протянуть проволоку через первую бисеринку, затянуть. Далее еще две коричневых, обратно возвращаемся, протягивая проволоку через первую коричневую и плетем второй бант так же как первый.
- Сделав вторую косичку с другой стороны, концы проволоки затянуть через жемчужину и выводим по разные стороны. Соединяем их внизу на середине, оба конца тянем через белую бисеринку.
- С разных сторон вводим проволочные концы в две красные бисеринки, затем по одной красной и выплетаем руки куклы идентичным косичкам способом.
- Выводим проволоку к двум красным первоначальным бусинкам, опускаем вниз, нанизываем по разным сторонам по две красных, потом через одну красную вывести оба отрезка проволоки.
- Далее формируем образ платья куклы по схеме: 2-4,6-8,10-12. Каждый ряд протягиваем повторно противоположным отрезком проволоки.
- Длину платья можно делать по желанию, поэтапно увеличивая количество рядов.
- Последний ряд из 12 бусинок протягиваем другим отрезком проволоки 10см, отступив с обеих сторон по 4 бусины. Сформировать ноги, протягивая желаемое количество бусин через концы.
Оставшуюся проволоку отрезать, закрутить плоскогубцами, спрятать отрезок под бусинки.
Как сплести плоскую фигурку из бисера: брелок-кот своими руками
Легкая и очаровательная голова маленького и веселого котика как брелок для ключей – сюрприз для любимого человека. Простая бисерная фигурка идеально подходит в качестве декоративной сережки, елочного украшения, самодельной брошки.
Необходимо:
- Латунная проволока около 70 см;
- Круглый бисер черного, белого цвета.
- Маленькие бисеринки зеленого цвета – 4 шт.;
- Бисер красного цвета – 9 шт.
Котики могут быть выполнены в разных стилях
Как сделать:
- Нанизываем на отрезок проволоки 8 черных бисерин, зафиксировать их с помощью перекрестного протягивания.
- Последующие ряды до шестого зрительно увеличиваем на две бусины каждый. В 6 ряду делаем начало глаз котика – три черных, две белых, шесть черных, две белых, три черных.
- 7 – й ряд – одна черная, две белых, две зеленых, одна белая, четыре черных, снова одна белая, две зеленых, две белых, одна черная.
- 8 ряд делаем как 6 – й.
- Последующий ряд уменьшаем на две бисерины.
- 10 рядок: пять черных, четыре красных, пять черных.
- 11 рядок: четыре черных, три красных, четыре черных.
- 12 рядок: три черных, одна красная, три черных.
- Последние два ряда постепенно уменьшаем на две бусинки каждый. Получается заостренная кошачья мордочка.
- Отдельно взять отрезок проволоки, протягиваем его через первый верхний ряд, нанизать 18 штук черного бисера, прогнуть в виде ушка, ввести в пятый ряд бусин, протянуть. Такое же ушко сделать с другого конца проволоки. Окончания скрутить, спрятать в середине бисерного ряда.
- Из двух центральных бусинок первоначального ряда протягивает проволоку, формируем цепное колечко для брелока.
Поскольку красные бисеринки символизируют носик животного, делаем усы. Через два красных бисера из первых четырех протянуть несколько отрезков лески, завязать их на узелки.
Плетение божьей коровки (видео)
Плетение бисером – полезное занятие, активно тренирующее навыки усидчивости малыша. Кстати, эта кропотливая работа имеет свойство антидепрессанта, поскольку отлично концентрирует внимание, успокаивает нервы и расслабляет после тяжелого трудового дня.
Другие виды рукоделия
Фигурки и игрушки из бисера
Из бисера Как из бисера сделать бабочку: многообразие вариантов5.2k.
Бисероплетение привлекает многих, тем более сейчас
Из бисера Как сделать собаку из бисера1.9k.
Сделать сувенир своими руками — особое удовольствие.
Из бисера Петушки из бисера: мастер классы и схемы884
Петух из бисера – это непросто уникальный и оригинальный
Из бисера Как плести из бисера сердечко3.4k.
Вниманию рукодельниц, любящих необычные и красивые
Из бисера Тигр из бисера1.4k.
Тигры – удивительные животные! Грация, красота, изящные
Из бисера Машинка из бисера803
Многие умеют делать с бисера браслетики или бусы, а
Из бисера Мишка из бисера: мастер класс748
Для любителей плетения из бисера или бусинок представлен
Из бисера Как сплести льва из бисера490
Перед вами мастер класс, благодаря которому даже новичок
Из бисера Плетем разных смешариков из бисера1.4k.
Вниманию рукодельниц предлагается подобный мастер-класс
Из бисера Как сплести слона из бисера767
Слон — символ мудрости и достоинства. Вы можете создать
Из бисера Как сделать лошадь из бисера1k.
Сделать своими руками сказочную или обычную лошадь
Из бисера Домик из бисера537
Бисер ‒ очень интересный и несложный материал.
Из бисера Куклы из бисера790
Все, кто увлекаются бисероплетением, не понаслышке
Из бисера Как сделать мышку из бисера2k.
Крохотные и забавные поделки из бисера в виде симпатичных
Из бисера Плетем цыплят из бисера783
Замечательным сувениром и подарком к Пасхе могут стать
Из бисера Схемы оплетения пасхального яйца бисером2.5k.
На Пасху давно принято разукрашивать вареные яйца.
Из бисера Объемный олень из бисера541
Совсем скоро придет самый любимый праздник взрослых
Из бисера Кролики и зайцы из бисера725
Плетеные из бусинок зайчики – это милые фигурки, которые
Из бисера Птицы из бисера1.1k.
Птица из бисера может стать отличным украшением интерьера
Из бисера Новогодние снежинки, ангелы, снеговики, звезды из бисера915
Новогодние поделки из бисера выглядят нарядно и становятся
Из бисера Как сплести из бисера котенка4.5k.
Кошечки и котята из бисера – одни из наиболее милых
Из бисера Плетем обезьяну из бисера339
Дарить игрушки, сплетенные из бисера, вовсе не обязательно
Из бисера Как сделать из бисера крокодила1.3k.
Плести объемные фигурки животных из бисера – увлекательное
Из бисера Рыбки, раки и морские звезды из бисера705
Как здорово иметь дома свою персональную золотую рыбку!
Из бисера Игрушки насекомые из бисера739
Загадочные существа со скелетом не внутри, а снаружи.
Из бисера Делаем лягушку из бисера916
Если вы хотите сделать небольшой оригинальный подарок
Из бисера Новогодние елочки из бисера3.1k.
Никогда еще игрушка не выглядела так натурально.
Из бисера Как из бисера сделать змею1.3k.
Несмотря на то, что мозгов у этой рептилии не больше
Из бисера можно сделать фигурку любого вида: усатого кота, забавную божью коровку, новогоднюю красавицу. Работа потребует минимум времени, если будут использоваться полезные советы по созданию мини-шедевров из небольших бусин. Предлагаем вам краткие уроки, которые помогут сотворить своими руками плоские и объемные поделки с помощью бисера, лески и проволоки.
Начинающие мастерицы смогут попробовать себя в деле бисероплетения, попытавшись воспроизвести простые линейные фенечки, браслеты-косички и «дорожки». Если вы уже знакомы с основными узорами, правилами и приемами, то можете попробовать сплести необычные игрушки в виде насекомых, животных и сказочных персонажей.
Бисер может стать удачным материалом для создания уникальных дизайнерских украшений, игрушек на елку, интерьерных композиций. Размер плетенных фигур ограничивается только количеством бисера и вашим желанием.
Что делать с созданными творениями? Дарите их друзьям, поднимайте настроение близким, украшайте себя и не забывайте, что каждый шедевр может превратить вас в известного мастера, который сможет творить на заказ.
Животные из бисера. Схемы для начинающих и для детей
Ищешь уникальный подарок для друга, хочешь изготовить необычный брелок или просто собираешься украсить комнату маленьким сувениром? Тебе сюда! Животные из бисера оригинально дополнят любую деталь гардероба и прекрасно впишутся даже в самый неординарный интерьер.
41 127 т.
Животные из бисера… Это они так красиво сияют на солнце, играя всеми цветами радуги. Кто не хотел бы иметь в кармане такое блестящее чудо? Изготовь объемную фигурку из бисера, и цветной лучик света всегда будет с Тобой.
Для плетения животных из бисера Тебе понадобятся: разноцветный бисер, тонкая проволока и… хорошее настроение.
А чтобы сделать плетение из бисера легким и непринужденным, включи любимую музыку и внимательно посмотри схемы животных. Они помогут Тебе правильно организовать работу. Я подготовил для Тебя целый зоопарк представителей фауны нашей планеты.
Симпатичный слоник — символ мудрости, силы и доброты. Подари его лучшему другу, и животное непременно принесет ему удачу.
Красавица-черепаха станет прекрасным украшением Твоей мобилки.
Объемный мишка из бисера — прекрасная альтернатива знаменитому Тедди.
Добро пожаловать в подводное царство! Галантный осьминог эффектно украсит коллекцию ракушек, привезенную Тобой из моря.
Опасный скорпион. Такой аксессуар обязательно понравится мальчикам.
А как Тебе вот такая забавная обезьянка?
Мечтаешь о собственном попугае? Яркая птичка из бисера сделает Твою мечту на шаг ближе. А еще от красочного попугая непременно будут в восторге поклонники мультика «Рио».
Гордый павлин из бисера может стать настоящей изюминкой интерьера.
Как Тебе идея сделать крутой брелок на рюкзак в виде лисички?
Розовый фламинго — прикольный сувенир на День рождения, тем более, если именинник мечтает побывать на озере Накуру в Кении.
Маленький секрет: если хочешь сделать животное больше, но боишься изменений в схеме, просто выбери бисер большего размера, при этом основание должно быть прочнее и толще, чем конечности. Тогда пропорции фигурки сохранятся, и схему менять не потребуется.
Плетение из бисера животных — занятие интересное и кропотливое, требует внимательности и настойчивости, зато результат Тебя непременно порадует. Так что если креативность, терпение и изобретательность — Твое второе «Я», скорее к работе: создавать животных из бисера.
Читай также:
Заметили орфографическую ошибку? Выделите её мышкой и нажмите Ctrl+Enter
Объёмные фигурки котов
Объёмные фигурки из бисера – это увлекательное занятие. При первом знакомстве со схемами объёмных фигурок кажется, что сделать фигурки – тяжёлая задача, но спешим заверить – это не так. Один совет – для придания жесткости элементам конструкции рекомендуем использовать тонкую проволоку.
В последнее время искусство по бисероплетению, стало особо популярным среди рукодельниц и мастериц. Это модное рукоделие дарит многим возможность сделать самостоятельно красивые и необычные поделки. Изделия из бисера не только красивы, они еще и разнообразны. Фигурки котиков из бисера особо популярны, ведь они воплощение ласки, мира, уюта и доброты.
Существует 2 вида бисероплетения: плоское и объёмное. Объёмное бисероплетение сложнее плоского, но при этом изделие получается интереснее. Такой вид рукоделия позволяет развивать мелкую моторику и творческое мышление.
Кот для начинающих
Для плетения объемного животного из бисера (в данном случае кота) нам необходима проволока (желательно светлая, так как темная будет выделяться на белом бисере и портить вид), бисер черного и белого цвета, а так же несколько бисеринок красного (для ротика), зеленого (для глаз), серого (для хвоста) цветов, а так же более крупную бисеринку розового цвета для носика.
Методом параллельного плетения выполняем работу по схеме, предложенной выше. Начинаем плетение с носа, заканчиваем хвостом.
При желании вы можете выполнить объёмное животное из бисера более крупное, например кот толстунчик, если увеличить схему пропорционально размерам данной.
Рыжий кот
Мы будем пополнять коллекцию котят таким милым, забавным котёнком из бисера. Мастер-класс поможет освоить технику объемного плетения бисером. Намного упрощает работу по бисероплетению котика схема, которая наглядно продемонстрирует в схематическом виде весь процесс работы. Именно этот мастер-класс отлично подойдет и для тех, кто только начинает осваивать этот вид работы, и уже для тех, кто имеет опыт.
Для работы нам понадобится:
- проволока диаметром 0,3 мм
- коричневый, белый, оранжевый, розовый и зеленый бисер 2,5 мм
- леска
Приступаем к работе, вначале необходимо отрезать кусок проволоки, длина ее должна быть два метра. Поначалу нужно сплести одну большую деталь, которая будет головой, затем туловище, после хвост для котенка. После этого можно приступать плести ушки, лапки, которые делаются по отдельности.
Плетём по схеме
Начинаем с головы котенка, не забываем, что во время плетения вставить для ротика две бисеринки розового цвета, а для глазиков понадобится вставить еще две бисеринки зеленого цвета. Берем для ушек два маленьких отрезка проволоки и делаем треугольнички. Для того, чтобы ушки закрепить на голове, нужно протянуть концы проволоки через бисерины головных рядов.
Делаем теперь лапки котику, для этого берем четыре кусочка проволоки большого размера и делаем их по схеме, также согласно показанной схеме, крепим лапки к туловищу. Переходим после этого к оформлению мордочки котенка, а именно делаем глазки. Берем черную краску и рисуем зрачки на каждой зеленого цвета бисеринке. Просовываем через мордочку сквозь бисерины небольшие куски лески, это будут такие усики. Такого котика можно использовать не только как декор, но и сделать из него брелок или подвеску к рюкзаку или сумке.
Кото-шарик
Для работы приготовьте:
- бисер
- леска (приблизительно 4 м)
- проволока
- бусинка (диаметр 15-20 мм, ее мы и будем оплетать)
Плетем сеточку в три бисеринки, ширина 2,5 ромба.
Когда половинка обхвата большой бусины будет готова леску надо закрепить (по красной линии на схеме). В этом случае, когда мы соединим сетку в колечко работа не расползется. Леску обрезать не надо!
Теперь отматываем от катушки еще 1-1,5 метра лески и плетём вторую половину сеточки. В ходе работы не забываем примерять сетку к бусинке. Она должна натягиваться плотненько.
Перед тем, как мы соединим сетку в колечко оба кончика лески должны находиться в одной стороне. Соединение пока не трогаем. Оно выполняется тем же концом лески, которым мы плели 2-ю половинку работы.
Разводим концы лески в разные стороны, продевая ее в бисеринки.
Макушку бусины доплетаем мозаикой. Можно плести по очереди с каждой стороны, чтобы сетка не сползала.
Здесь длина сетки 14 ромбиков, 4 ряда плетения без убавок, в 5 ряду убрано 6 бисеринок и в 8 убрано еще 4 штуки.
Морда
Объемное бисероплетение – совсем не сложно, если внимательно изучить схему. Продолжаем. На фото звездочками помечены места, где прикрепляются щёчки и носик. Здесь надо прошить два-три раза, но не туго, выходим из розовой бисеринки и подтягиваем двумя стежками к самой основе.
Подбираем глазки.
На этом этапе мордочку оставляем. Переходим к котику с конца.
Подводим иглу к месту, где крепится хвост.
Двигаемся к ушкам.
Когда ушки будут готовы, кончик лески закрепляем и отрезаем. Если же лапы будут из лески – оставляем так.
Лапы
Находим ось симметрии. Выбираем бисеринки, к которым будем крепить лапки.
Для закрепления проводим проволоку через 2-3 бисеринки. Выходим из бисерины от лапок.
Лапки из лески делаем в два прохождения – на втором пропускаем самую ближнюю к белым бисеринам бусину. Это нужно чтобы котик стоял на полной лапке.
Лапки готовы.
Усы
Наматываем 10-15 см лески. Связываем моточек посередине узлом.
Маленьким крючком протягиваем петельки мотка между носиком и щечкой снизу вверх с каждой стороны. Один кончик надо пропустить через бисеринку основы или носика и связать со вторым кончиком, потом заправить в сторону моточка. Подстричь усы.
тот урок объемного бисероплетения закончен. Наш котик готов!
Обьемная шкатулка-сердце из бисера. Плетение из бисера. Бисероплетение. Beading
Watch this video on YouTube
Кот и пантера
Сегодня мы предлагаем вам схему плетения брелков – объемных фигурок из бисера, котика и пантеры. Схема прилагается.
В данном случае мы видим, как выглядит пантера.
Ниже описано как сделать шарики на основе кольца и 4-х бисерин, ведь именно этот метод используется в технике плетения наших фигурок.
Выполняется шарик одним кончиком проволоки или лески, без основы. Схема собирания шарика показана на рисунку 111. В плетении используем бисер с крупными отверстиями.
Набираем на леску 4 бисеринки и замыкаем их в колечко, скрещиваем оба конца (рабочий и не рабочий) в бисерине. Как это сделать показано на рисунке 112 а. Узел в конце не завязывать. Оставляем хвостик длиной 6-7 см.
Снова набираем 3 бисерины и замыкаем в колечко, проводим конце лески в бисеринки 7 и 2 колечка-основания. Смотрите рисунок 112 б. Набрать 2 бисерины и замкнуть их в следующее колечко, пропускаем кончик лески в бисеринку 5 предыдущего колечка, сверху вниз и в бисеринки 2 и 3 колечка основания (смотрите рисунок 112 в).
Таким же образом выполняем еще одно колечко, леску проводим в бисеринки 8, 3 и 4, а далее – в бисеринку 7 первого колечка снизу вверх (рисунок 112 г).
Набираем на леску 1 бисеринку и пропускаем ее кончик в бисеринки 10, 4, 7 (смотрите рисунок 112 д). Теперь шарик надо стянуть, он обретет объемную форму. Чтобы это сделать, проводим конец лески через бисеринки 6, 9, 11, 12. Леску туго натянуть. Чтобы закончить работу, протягиваем леску в бисеринку 7 сверху вниз (смотрите рисунок 112 е).
Далее завязываем узел из лески рабочего и не рабочего концов, концы лески подрезаем и оплавляем. Получился шарик из трех вертикальных рядочков бисерин, в каждом ряду – по 4 бисеринки. Всего – 12 (смотрите рисунок 113).
Вот что у нас получилось:
Чёрный кот
Подбираем ткань для игрушки. Складываем ее вдвое и вырезаем. Ниже на схеме указано какие детали и как нужно вырезать.
Схема
Детали головы сшиваем, набиваем головку ватой, зашиваем отверстие. У основания каждого ушка сделать маленькую складку и пришить уши. Пришиваем носик, глазки, вышиваем рот, делаем усы из ниток.
Теперь подготавливаем каркас, как показано на схеме ниже. Для этого необходимо взять 3 куска проволоки нужной длины, скрутить их вместе в центре. Делаем это так, чтобы одна из наших проволочек стала шейкой, переходящей в хвостик, две другие – лапками.
Обмотаем туловище котика ватой и нитками. Прикладываем к спинке кота обшивку для туловища, до этого сделав на ней небольшие надрезы для шейки и хвостика. Зашиваем внизу живота. Спереди и сзади обшивку подгибаем внутрь и зашиваем так, чтобы не было видно края.
Нанизываем на шею, лапки и хвостик бисер. Придаем нужную форму нашему каркасу. Лапки собираются на ниточку, используем шов «через край». На затылке котика делаем отверстие, вставляем в него петлю шейки из проволоки. Зашиваем отверстие.
Наша объемная игрушка из бисера готова!
Кот Толстунчик
В данной модели игрушки схемы нет, но сам принцип плетения будет представлен ниже с подробным описанием.
Нам нужен бисер для тела котика — серого или черного цвета, белый для мордочки, лапок и брюшка и красный для носика, вата для набивки, проволока для основы, мононить и “Пластика” для основы.
Изобретательность приветствуется всегда. Поэтому эта фигурка сделана автором из… жевательной резинки.
Плетение начинается с мордочки.
Используется прямое плетение или мозаикой. Можно бисером другого цвета сплести пятна или полоски на шкурке кота. Можно внести изменения с помощью более крупного бисера, все зависит от вашей фантазии.
Лапки и хвостик выполняется техникой мозаичного жгута, их мы пришиваем отдельно.
Посмотрите на котика с разных ракурсов, так станет боле понятна техника плетения.
Наша объемная игрушка из бисера готова!
Золотистый кот
Подготавливаем набор необходимых принадлежностей:
- бисер основного цвета (золотистый)
- для окраса пузика и лапок бисер серебристого цвета
- для глаз бисер зеленого цвета
- для носика и ротика розовый и красный бисер
- для создания тела один шарик большого размера
- для головы шарик несколько меньше, нежели для тела
- для хвоста и лапок проволока
- леска для ушек
- инструменты для бисероплетения
- бисер в тон нитки
Вначале мы будем делать туловище котику. Для этого нужно покрасить большой шарик в тон основного цвета, которым будет котик. Оставляем при этом только не закрашенным белое пузико. Можно для работы подобрать шарик в нужный цвет.
После просыхания краски продолжаем работу. По всей окружности шарика начинаем плетение цепочки на нить бисером. Для удобства закрепляем шарик подручными средствами, после этого продолжаем плетение, увеличивая постоянно, незабываем, что нам нужно вставлять серебристый бисер делая, таким образом животик котику.
Когда ряд вдоль окружности шара получится широкий, начинаем убавлять по бисерине.
Теперь начинаем делать хвостик и лапки. Для этого берем небольшой отрезок проволоки и складываем ее пополам.
На серединку проволоки надеваем бусину в цвет основного окраса кота. Нанизываем бисер до половины проволоки, затем надеваем несколько бисерин серебристого цвета и затем снова золотистого. Должно в итоге получиться одинаковое количество бисерин, теперь сгибаем проволоку пополам и закручиваем ее. Так делаем все остальные лапки.
Самый длинный кусок проволоки будет для хвостика, плетем его точно также как и лапы. При помощи кончиков проволоки лапок и хвоста закрепляем их к телу котика. Пропускаем проволоку сквозь бисерину в предполагаемом месте, и оставшиеся проволоки скручиваем вокруг проволоки. Отрезаем оставшиеся или накручиваем на лапу, придерживаемся при этом симметрии.
Теперь делаем голову кота, для этого берем шарик, который мы заранее приготовили. Если не оказалось такого, то можно просто взять кусок фольги и свернуть ее, сделав шарик диаметром немного меньше, нежели туловища кота. Шарик окрашиваем под основной цвет кота акриловой краской.
Закрепляем его, пропустив сквозь шар иглу с леской, и начинаем оплетать голову бисером. Начинаем с пояска плетем как и тело. Как завершающий этап создаем котику симпатичную мордочку.
Берём две бусины зеленого цвета и симметрично пришиваем их одну возле другой. Нос и ротик проплетаем сквозь бисерин мордочки розовыми бусинами.
Для ушек создаем угол из проволоки и нанизываем на нее бисерины, делать их можно любой формы по желанию. Для усов используем лески, которые пропускаем сквозь мордочку на месте носика.
Осталось закрепить голову к туловищу, а потому на одном из двух шариков проплетаем один ряд крестиками из бисера, так мы формируем шею. Затем пришиваем голову к туловищу и плотно затягиваем все нити. Для декора можно сделать бантик и прикрепить котику из любой тесьмы. Теперь котик готов.
Влюблённый кот
Для выполнения вот такой объемной игрушки из бисера в виде красивого котика нам нужно: бисер двух цветов – на окрас и на животик и лапки. Красный бисер на сердце. Совсем чуть-чуть бисера для рта, глаз и носика, а также шарик (для пинг-понга). Леска, проволока. Бусины на лапки и хвост (потолще) и уши (потоньше).
Шарик красим под цвет кота и оставляем кружочек под животик.
По крашеному шарику плетем крестиком цепочку по его окружности. Шарик стоит проколоть накрест, чтобы оплетка не скользила по нему.
Наплетаем полоску по обе стороны от белого пятнышка таким образом, как показано на фото. Когда ряд становится слишком широким – убавляем (плетем две бусины как одну).
Получаем оплетеный шарик. Это тело котика.
Далее займемся хвотиком и лапами. На проволоку, сложенную пополам, надеваем бусину и закручиваем, оставляя кусочки на 2-3 см. Делаем 5 заготовок. Самая длинная – для хвоста. Самые короткие для передних лап.
Прикрепляем хвост и лапы к телу котика таким способом: продеть через бисерину, закрутить и убрать кончик (обкусить). Можно не обкусывать, а просто обмотать.
Теперь лапы и хвост надо оплести. Делаем это способом мозаичного жгута. В данном случае – на 5 бисеринах с 3 бисеринами в основе.
Когда доплетаем до бусинки – на край жгута наплести крестик с прибавлением. После этого оплетаем саму бусину. Таким образом делаем все лапы и хвост. Для головы берем фольгу, скатываем в шарик. Оплетаем его таких же способом, как оплетали шарик. На месте мордочки убавлений делать не надо.
Сердце делается так: плетется полотно крестиком по форме сердечка, делаем таких 2 штуки. Расчет – 5х3 крестика. Далее сшиваем крестиком же, внутрь вставляем бусины и все это надо пришить к лапкам котика.
Делаем мордочку: глазки-бусинки пришиваем. Носик и мордочку надо проплетать между бисерин нашей оплетки. Делаем уши и усы.
Крестиком приплетаем голову к телу.
Закрепляем леской с помощь иглы.
Объёмная игрушка из бисера готова. Симпатичный котик, которого не стыдно подарить.
Белый кот
Для объёмных фигур, таких, как белый кот из бисера, используется леска или проволока, на леске изделие получается лучше. При объёмном бисероплетении указанное на схеме количество бисерин набирается в замкнутое кольцо, а затем добавляются новые ряды.
Двумя иглами набираем цепочку из 14 пар бисерин (рисунок 1),замыкаем цепочку в кольцо, соединив начало и конец. Обе иглы выводим в одну сторону, через пары кольца, находящиеся напротив стыка. Плетём ещё одну цепочку из 6 пар бисерин. Получился каркас головы кота. Полностью голову мы делаем по схеме номер 2.
Уши кота плетём по схеме на рисунке 3, приплетая их к основе головы в месте, указанном на рисунке 4. На этой основе головы с ушами нужно сделать дополнительные подплетения, имитирующие шерсть (рис.5). Пометим 3 бисеринками га мордочке нос, сделаем глазки и прикрепим нос. Усы плетём из мелкого жемчужного бисера – 8, 8 и 6 бисеринок в каждом усике кота (рис.6).
Приплетаемся к бусинам головы и делаем туловище (рис.7). После того, как сделали туловище, приплетам к нему лапы и хвост (рис.8,9,10).
Чтобы белый кот получился пушистым, нужно выполнить дополнительные подплетения (рис 8). За счёт подплетений можно получить разные фигурки котов. Можно сделать белого и чёрного кота, выбор за вами.
Объёмная фигурка Кошка Мурка
Котёнок с бантиком и с мышкой
Плетение начинается с носа, и затем плетём голову (рис.1).
Тут заканчиваем плести голову, начинаем уши (рис. 2).
Дальше плетём тело (рис. 3,4,5).
Плетём переднюю лапку (рис. 6).
Задняя лапка (рис. 7, 8).
Далее, делаем хвост (рис. 9,10).
Бантик на шею, можно сделать из любых бусинок.
Мышка из бисера.
Мышка в смокинге
Смотрим на рисунки, всё можно понять по рисункам. Начинаем с головы.
Туловище фигурки.
Ноги нашей мышки.
Ручки мышки, смотрим на главное фото.
Волюметрическая кальциевая визуализация 1 миллиона нейронов в областях коры при клеточном разрешении с помощью микроскопии световых шариков
Генерация световых шариков с помощью MAxiMuM
Целью LBM является облегчение мезоскопической волюметрической визуализации Ca 2+ , совместимой с оптимальными пространственно-временными условиями взятия проб выше. Для достижения этой цели мы создали автономный модуль под названием MAxiMuM, способный генерировать необходимые столбцы мультиплексированных лучей. Лазерный свет фокусируется на входе в полость MAxiMuM и повторно отображается серией вогнутых зеркал (рис.1б, подробные схемы на рис. S1 и S2). Существует преднамеренное смещение Δz между номинальным фокусом зеркал повторного формирования изображения и входом в резонатор, таким образом, когда луч возвращается на вход, происходит осевое смещение его фокуса. Прежде чем достичь входа в полость, луч встречает частично отражающее зеркало, которое отражает большую часть света обратно в полость для следующего обхода с небольшим боковым смещением относительно первого луча. Оставшаяся часть света выходит из полости и попадает в расположенный ниже по потоку микроскоп.Из-за фокального смещения каждый луч, выходящий из резонатора, фокусируется на меньшую глубину в образце с относительным уменьшением оптической мощности, так что мощность в луче i th равна P i = T (1 — T ) i , где T — пропускание частично отражающего зеркала.
В области 2pM хорошо известно, что поддержание отношения сигнал / шум на глубине требует экспоненциального увеличения мощности лазера из-за потери баллистических фотонов из-за рассеяния на ткани.Отсюда следует, что пропускание полости, T , можно отрегулировать таким образом, чтобы относительное увеличение мощности для каждого последовательного луча соответствовало увеличению, необходимому для компенсации дополнительного рассеяния ткани из-за осевого разделения между соседними плоскостями, δz , и таким образом достигается постоянное отношение сигнал / шум для всех мультиплексированных лучей. Это условие определяется: где l с — длина свободного пробега ткани мозга при рассеянии (∼200 мкм для длины волны лазера 960 нм 38 ) и соотношение между осевым разделением лучей, выходящих из полости ( Δz ), по сравнению с в образце ( δz ) имеет вид Δz = M 2 δz , где M — боковое увеличение микроскопа.Уравнение (1) обеспечивает правило проектирования для достижения заданной осевой плотности отбора проб с помощью подхода LBM (см. Дополнительное примечание 1). Эта гибкость конструкции представляет собой отличительную особенность LBM и ключевое отличие от реверберационной микроскопии, где пропускание обязательно фиксируется на уровне 50%, что приводит к δz ~ 100 мкм в ткани мозга и ограничивает возможную множественность ~ 8- сгиб на глубине проникновения 2 пМ.
Мы разработали наш модуль MAxiMuM на основе существующего мезоскопа (NA = 0.6, FOV = 6 мм, рис. S3) и охарактеризовал каждый световой шарик в пространстве образца (рис. S4, дополнительное примечание 2), чтобы гарантировать желаемые временные и пространственные характеристики. Посредством этих калибровок мы подтвердили ограниченное время жизни флуоресценции задержки между шариками (6,7 нс) и минимальные перекрестные помехи между каналами, в то время как осевое положение, в котором сфокусированы наши шарики, линейно увеличивалось с числом шариков для наших 30 световых шариков в общей сложности. осевой диапазон ~ 500 мкм. Мы также подтвердили, что поперечный и осевой диаметр локализации наших световых шариков составляет ∼1 мкм и ∼13 мкм соответственно; Достаточно для получения изображений с клеточным разрешением плотно меченых образцов.
Оптимизация эффективности пространственно-временной выборки
Чтобы максимизировать пространственно-временную эффективность выборки и запись с максимально возможным полем обзора, необходимо записывать только минимальную информацию, необходимую для точного извлечения интересующих характеристик — в нашем случае тела нейронных клеток. Соответственно, мы намеревались определить минимальные требования к пространственной выборке, чтобы разрешить переходные процессы GCaMP нейронов неокортекса мыши. Мы записали несколько одноплоскостных стеков данных с высоким разрешением и отправили их в конвейер анализа (рис.S5, подробности см. В дополнительном примечании 3), сравнивая извлеченные следы и временные ряды с ручными сегментами функциональных наземных истин для каждого набора данных. Используя оценку F (определяемую как среднее гармоническое значение истинных и ложноположительных результатов) в качестве показателя точности извлечения, мы оценили, как ухудшается производительность в зависимости от разреженности выборки, удаляя пиксели из стеков боковых изображений. В соответствии с нашими предыдущими результатами, 24, 25 , мы обнаружили, что F-оценка значительно снижается только для латеральной пространственной выборки> 5 мкм (рис.S6a). Таким образом, чтобы максимизировать объем изображения при сохранении высокой точности извлечения сигнала, мы нашли оптимальную выборку ∼5 мкм в боковой плоскости.
Дополнительным фактором при оптимизации микроскопа является размер и форма PSF. Как мы показали ранее, 24, 25 увеличенный, сфокусированный во времени PSF увеличивает чувствительность обнаружения нейронов в режиме разреженной выборки за счет повышенного спроса на энергию импульса на воксел для поддержания отношения сигнал / шум.Для этой первоначальной демонстрации LBM мы использовали оптимальную чувствительность, чтобы увеличить отношение сигнал / шум на луч с максимально возможной степенью множественности (и, следовательно, с максимально возможным полем обзора) в рамках ограничений бюджета мощности. Тем не менее, наше моделирование (рис. S6a) предполагает, что точность экстракции системы достаточна для обнаружения большинства активных клеток в пределах поля зрения.
Мультирегиональная и мультисенсорная визуализация активности> 200000 нейронов в коре головного мозга мышей
Мы проверили LBM, выполнив визуализацию in vivo неокортекса бодрствующих и ведущих мышей, трансгенно экспрессирующих GCaMP6 в глутаматергических нейронах. 5, 37 Используя нашу оптимизированную стратегию пространственной дискретизации в объеме ∼3 × 5 × 0,5 мм 3 , мы могли поддерживать частоту кадров ∼5 Гц, совместимую с разрешением переходных процессов GCaMP. Мы сориентировали поле зрения так, чтобы охватить как можно больше различных областей в пределах одного полушария коры, включая SSp и PTLp, а также RSP и VISp (рис. 2a) на глубинах, соответствующих слоям с I по IV (рис. 2b). Чтобы вызвать активность нейронов, распределенных по множеству функциональных областей в пределах поля зрения, мы разработали парадигму двойных сенсорных стимулов, включая усы и визуальную стимуляцию.Во время испытаний усов мы повредили большинство усов, контралатеральных по отношению к изображаемому полушарию. Каждая визуальная проба состояла из высококонтрастной дрейфующей решетки с ориентацией в соответствии с последовательностью горизонтального, 45 °, вертикального, 135 °, которая повторялась до на протяжении всей записи. Общая парадигма стимулов состояла из проба с усами, визуального испытания, за которым следовали одновременные испытания с усами и зрительный образ с 5-секундными интервалами между каждым испытанием. Кроме того, наша беговая дорожка была оборудована системой отслеживания скорости и видеозаписи животных с фиксированной головой, чтобы фиксировать движения задних или передних конечностей, связанные со спонтанным поведением, т.е.Движения, которые не были результатом тренировки или вызваны внешними стимулами (фильм S1). Типичные записи в этой модальности варьировались от 9 до продолжительностью 30 минут, давая популяции из 159 — 460 000 нейронов (12 записей от N = 6 мышей, см. Рис. S6a).
Рис. 2: Запись 207 030 нейронов в объеме ∼3 × 5 × 0,5 мм 3 у мыши, экспрессирующей GCaMP6s, с частотой 4,7 Гц.a , 3D-рендеринг извлеченных пространственных координат нейронов и максимальной прогнозируемой активности для 9-минутной записи.Поперечное изображение мозга воспроизведено из работы. 53. См. Также фильм S2. b, Y-Z проекция плотности нейронов; примерные границы между корковыми слоями обозначены зелеными линиями; все значения глубины отображаются относительно pia. c, Среднее проекционное изображение по записи на глубине 344 мкм. Масштабная линейка: 250 мкм. Вставка: увеличено в области c , масштабная линейка: 100 мкм. См. Также Movie S3. d, Тепловая карта всех 207 030 нейронов, извлеченных из записи в a , нормализованная до максимального значения ΔF / F 0 . e , подмножество 3000 трасс от c показано в полном разрешении. f , подмножество из 50 следов от g с усами и визуальными стимулами, обозначенными красными и синими маркерами соответственно. Смещение: 0,5 ΔF / F 0 .
На рисунке 2 показаны данные репрезентативной 9-минутной записи 207 030 нейронов, распределенных в осевом диапазоне ~ 500 мкм в пределах нескольких областей коры, упомянутых выше (объемная визуализация на фиг. 2a и Movie S2).Как и ожидалось (рис. S6), и в соответствии с пространственно-временными характеристиками световых шариков, генерируемых MAxiMuM (рис. S4), отдельные нейроны действительно могут быть точно разрешены (рис. 2c, Movie S3), что позволяет извлекать с высокой точностью их временные ряды (рис. 2d – 2f). Из-за огромного количества данных трудно одновременно отобразить временные ряды всех 207 030 нейронов с полным разрешением. На рис. 2d показана обзорная тепловая карта всех нейронов (см. Фильм S4), а на рис. 2е показана подробная тепловая карта подмножества из 3000 нейронов, демонстрирующих периодическую активность, вызванную стимулом.Следы для дополнительного подмножества из 50 нейронов показаны более подробно на рис. 2f, причем визуальные и усовидные пробы обозначены синими и красными метками соответственно. Временная шкала наблюдаемых переходных процессов кальция согласуется с характерным временем отклика GCaMP6s (рис. S7) и показывает корреляцию как с визуальными, так и с усовыми стимулами.
Для дальнейшего исследования настройки нейронов на внешние переменные, мы вычислили распределение корреляций между временными рядами каждого нейрона со скорректированными лагом, свернутыми по GCaMP-ответу-ядром временными векторами, связанными с предъявлением каждого из стимулов. , и.е . испытания усов, визуальные испытания, а также корреляция со спонтанным, неинструктированным поведением животных, включая движения передних или задних конечностей (рис. S8a – 8c). Мы обнаружили субпопуляции нейронов, охватывающих многие области коры (рис. 3a – 3e), которые были сильно настроены на каждый стимул ( R> 3 σ , где σ — стандартное отклонение соответствия нормального распределения распределению корреляций между временными рядами нейронов и перетасованным во времени вектором стимула, подробности см. в Методах), насчитывающих 34 468 нейронов с усами, 24 299 нейронов с визуальной настройкой и 64 810 нейронов, настроенных на неинструктированное поведение животных.
Рис. 3: Анализ активности нейронов, настроенных на стимулы и коррелированных с поведением, при записи в одном полушарии.a , Области мозга, охваченные записью, показанной на рис. 2, воспроизведены из работы. 53; SSp = первичная соматосенсорная область, LL = домен нижней конечности, UL = домен верхней конечности, SSp-TR = домен туловища, BFD = бочкообразное поле, PTLp = задняя теменная ассоциативная область, VISp = первичная визуальная область, RSP = ретросплениальная область. Масштабная линейка: 250 мкм. b – e , Поперечное пространственное распределение нейронов, настроенных на одно условие стимула.Корреляционная матрица (см. Рис. S8d) для всех настроенных нейронов была иерархически сгруппирована и отсортирована по предпочтительным стимулам, генерирующим 4 кластера, представленных синим, зеленым, желтым и красным цветом соответственно на всех рисунках. Каждая карта соответствует стимулам усов, визуальным стимулам или поведению соответственно, причем e соответствуют популяции нейронов, не коррелированных ни с одним стимулом. Масштабные линейки: 250 мкм. f – i , Пример нейронных следов из популяций, настроенных на раздражители усов, зрительные стимулы, спонтанное поведение или некоррелированные, соответственно.Появление стимулов обозначается маркерами в соответствующих случаях. Смещение: 1.0 ΔF / F 0 . j, k , усредненная по пробам активность примеров нейронов с усовыми настройками с (пурпурный в j , голубой в k ) и без (серый) присутствием одновременного визуального исследования. В – активность нейрона, настроенного на усы, положительно модулируется, т. Е. Увеличивается, когда визуальные стимулы предъявляются одновременно; в k другой нейрон с усами имеет отрицательную модуляцию.Сплошные линии обозначают среднее значение всех испытаний, заштрихованные области обозначают 1 стандартное отклонение от среднего. l , Боковое пространственное распределение пурпурной и голубой популяции в j и k . Масштабная линейка: 250 мкм. m , латеральное пространственное распределение визуально настроенных нейронов, положительно и отрицательно модулируемых одновременными раздражителями усов. n , латеральное пространственное распределение нейронов с усами, положительно и отрицательно модулируемых одновременным поведением животных. o , латеральное пространственное распределение визуально настроенных нейронов, положительно и отрицательно модулируемых одновременным поведением животных. p , единичная пробная активность, например нейроны, настроенные на раздражители усов для испытаний с одновременными визуальными раздражителями. Крайний левый переходный процесс показывает усредненную по опыту активность, а заштрихованная часть обозначает 1 стандартное отклонение от среднего. Необработанные данные для каждого примера переходного процесса в испытаниях 1–15 показаны маркерами, черные линии обозначают отклик после деконволюции; координаты каждого нейрона указаны в миллиметрах для каждого нейрона; горизонтальная и вертикальная шкалы: 1.0 ΔF / F 0 , 5 с. q , единичная пробная активность, например нейроны, настроенные на неинструктированное поведение животного; крайний левый переходный процесс показывает усредненную по опыту активность с заштрихованной частью, обозначающей 1 стандартное отклонение от среднего; необработанные данные для каждого примера переходного процесса в испытаниях 1–5 показаны маркерами, черные линии обозначают отклик после деконволюции; координаты каждого нейрона указаны в миллиметрах для каждого нейрона; горизонтальная и вертикальная шкалы: 1.0 ΔF / F 0 , 5 с. r , Тепловая карта усредненной по пробам активности нейронов с настраиваемым поведением с относительной задержкой, обозначенной наложенной черной линией. Тепловая карта нормализована до максимального значения ΔF / F 0 для каждого нейрона, а пробное усреднение включает 5 лучших испытаний поведения на самой высокой скорости. s , Боковое пространственное распределение нейронов, настроенных на поведение, обозначенных цветом по относительной задержке. Масштабная линейка: 250 мкм. См. Также Movie S5. t , Кумулятивная доля популяций, настроенных на данное состояние (стимул усов, визуальный стимул, спонтанное поведение, некоррелированное) со значительной взаимной корреляцией ( R> 3σ ), захваченных в пределах данного разделения нейронов и нейронов.
Мы выполнили иерархическую кластеризацию на матрице взаимной корреляции популяции всех 123 577 нейронов, настроенных на стимул (рис. S8d), и обнаружили 4 отдельных кластера, определенных путем обеспечения одинаковых расстояний от узла до ствола для каждой результирующей ветви дендрограммы. Впоследствии мы сопоставили эти кластеры и нейроны внутри них с их анатомическим расположением в головном мозге. На рисунках 3b-3d показано латеральное пространственное распределение нейронов по всей коре, связанных с данным состоянием (стимуляция усов, визуальная стимуляция и неинструктированное спонтанное поведение соответственно), с цветовой кодировкой их соответствующих кластеров, а на фиг.3e показано латеральное распределение 13 259 нейронов, не коррелированное с каким-либо условием стимула ( | R | <σ ). Для большинства условий стимула можно наблюдать распределение соответствующим образом настроенных нейронов по множеству областей коры (рис. 3а). Для каждого условия, а также для некоррелированной популяции мы можем точно выделить переходные процессы отдельных ячеек, как примеры, показанные на рис. 3f – 3i соответственно демонстрируют.
Кластер 1 (синий) располагался преимущественно в поле ствола (SSp-BFD) и PTLp (рис.3а), и, соответственно, был широко представлен в популяции с усами (рис. 3б). Этот кластер также был широко представлен в популяции, коррелирующей со спонтанным поведением (рис. 3d), что предполагает смешанный ответ нейронов в этом кластере на оба стимула. Кластер 2 (зеленый) был представлен только в нейронах с настраиваемым поведением (рис. 3d) и в основном располагался в специализированных областях SSp, связанных с ощущениями в нижних конечностях, верхних конечностях и туловище животного (SSp-LL, SSp- UL и SSp-TR соответственно), а также PTLp (рис.3а). Кластер 3 (желтый) был расположен в VISp и PTLp и представлял нейроны, коррелированные со всеми условиями стимула. Присутствие визуально связанных нейронов в популяции, настроенной на усы, могло быть связано с тем, что животное могло видеть движение кисти, стимулирующее усы во время предъявления стимула. Последний кластер 4 (красный) был распределен по нескольким регионам, включая SSp, VISp, PTLp и плотную популяцию внутри RSP, которая, как считается, связана с кодированием пространственной памяти. 39 Было обнаружено, что это подмножество, расположенное внутри RSP, в первую очередь настроено на неинструктированное спонтанное поведение (рис. 3d). Анализ пространственной кластеризации предполагает, что, хотя некоторые из этих функциональных кластеров перекрываются с различными анатомическими областями мозга, нейроны в этих областях также могут совместно представлять несколько условий стимула или могут иметь вызванную стимулом активность, которая дополнительно модулируется наличием дополнительных стимулов. .
Для дальнейшего изучения смешанного представления мы проанализировали усредненную по пробам активность нейронов, настроенных на стимул.Во-первых, мы рассмотрели разницу в усредненной в испытании активности нейронов с усами для испытаний, в которых присутствовал только стимул усов, по сравнению с испытаниями, в которых одновременно возникали и усы, и зрительные стимулы (рис. 3j-3l). Примеры усредненных по пробам переходных процессов как для положительно, так и для отрицательно модулированного нейрона показаны на рис. 3j и 3k соответственно. Латеральное пространственное расположение значительно ( p < 0,05, определено с помощью t-критерия) модулированных вверх и вниз нейронов показано на рис.3л. Было примерно одинаковое количество нейронов, настроенных в виде усов, положительно (3703 нейрона) и отрицательно модулированных (4166 нейронов). Однако было четкое различие между анатомическим расположением двух популяций: положительно-модулированные нейроны, расположенные в основном в SSp-BFD, и отрицательно-модулированные нейроны, расположенные в VISp. На рис. 3м показана карта визуально настроенных нейронов, активность которых существенно модулируется одновременным предъявлением стимулов усов. Визуально настроенные нейроны в основном отрицательно модулировались наличием раздражителей усов и располагались внутри VISp.Рисунки 3n и 3o показывают популяцию усов и визуально настроенных нейронов, значительно модулированных совпадающими неинструктированными спонтанными поведениями животного. В обоих случаях большинство нейронов с усами и визуальной настройкой позитивно модулируются спонтанным поведением.
Кроме того, на уровне отдельного исследования, популяции, настроенные на стимулы и поведение, демонстрируют значительные различия между нейронами и между испытаниями. На рисунке 3p показан пример следов восьми нейронов, настроенных на раздражители усов в присутствии совпадающих визуальных стимулов.Во всех случаях ответ данного нейрона значительно варьируется от испытания к испытанию. В некоторых случаях нейроны, анатомически разделенные более чем на 1 мм, демонстрируют вариации активности между испытаниями, которые коррелированы (нейроны 1–4), в то время как в других случаях вариации активности от испытания к испытанию не совпадают ни с вышеуказанной группой, ни друг с другом. (нейроны 5–8). На уровне популяции мы обнаружили, что корреляции между экспериментами между нейронами с усами (рис. S9a) и нейронами с визуальной настройкой (рис. S9b) имеют положительный перекос ( r = 0.16 ± 0,24 и r = 0,26 ± 0,29 соответственно) и согласуются с ранее измеренными значениями. 40
На рисунке 3q показан пример единичных пробных ответов нейронов, настроенных на неинструктированное поведение. Ответы этих нейронов не просто колеблются в величине одиночных переходных процессов, но также демонстрируют вариабельность общего количества переходных процессов, а также времени начала их ответов в ходе испытаний. Мы количественно оценили эту изменчивость во времени начала, вычислив запаздывание времени начала активности каждого настроенного на поведение нейрона по отношению к началу поведения, и нашли a ~ 1.7-секундная задержка между временем пика активности самого раннего и самого позднего нейронов. Рис. 3r показывает тепловую карту настроенной на поведение популяции, отсортированной по предпочтительному лагу и пробному усреднению по 5 верхним движениям с наибольшей скоростью, тогда как на рис. 3s показаны латеральные положения этих настроенных на поведение нейронов, окрашенные в цвет по относительному времени начала (фильм S5 ). Самые ранние отвечающие нейроны в основном расположены в областях мозга SSp-TR, SSp-LL и SSp-UL, в то время как нейроны в областях, более удаленных от этих сенсорных областей, включая RSP, PTLp, SSp-BFD и VISp, отвечают. значительно позже, в соответствии с предыдущими результатами в литературе. 11
Пространственная и временная структура нейронов, зафиксированных в этих записях, подчеркивает необходимость мезомасштабной и объемной записи. Настроенные на стимулы, настроенные на поведение и некоррелированные нейроны в записи, показанной на рис. 2 и 3 демонстрируют коррелированную активность, которая охватывает расстояния между нейронами на 2–4 мм (Fig. 3t), и, таким образом, требует записи в мезомасштабе для захвата динамики всей популяции. Кроме того, нейроны, настроенные на стимулы, демонстрируют изменчивость реакции от испытания к испытанию, которая, по-видимому, зависит от популяции, несмотря на разделение попарными расстояниями в мезоскопических масштабах (рис.S9c) и располагаясь в осевых слоях по всей глубине коры (Fig. S9d ) . Такие ковариации нейронных ответов, также называемые «шумовыми корреляциями», были предложены для представления распределенной, закодированной информации более высокого измерения, лежащей в основе взаимодействия внешних стимулов и поведенческих состояний с внутренними состояниями, или для представления информации, относящейся к неконтролируемым аспекты предъявления стимула или неотслеживаемые поведенческие состояния. 11, 41 Из-за внутренней природы корреляций шума, которые меняются в зависимости от испытания, любое пробное усреднение принципиально препятствует их обнаружению.Таким образом, хотя последовательные записи поля зрения в одной плоскости и мозаики потенциально могут захватывать одну и ту же популяцию клеток, показанную здесь, вариабельность их ответов, записанная с помощью нашего метода, от испытания к испытанию при таком подходе по своей сути теряется. Более того, поскольку считается, что эти шумовые корреляции кодируют информацию о состоянии мозга, неинструктированном поведении или непреднамеренных стимулах, отсюда следует, что устранение неоднозначности популяции нейронов с коррелированными вариациями (нейроны 1–4, рис. 3p) от тех, у которых нет корреляции между пробами и экспериментами. пробная активность (нейроны 5–8, рис.3p), а также надежность любой информации, переносимой проекциями динамики всей популяции, будет улучшаться по мере увеличения числа зарегистрированных нейронов аналогично традиционному кодированию стимулов в первичных сенсорных областях. 9, 41
Реконфигурируемая многомасштабная визуализация с помощью LBM
LBM поддерживает возможность поиска компромиссов между дискретизацией боковых вокселей, полем обзора и скоростью визуализации для соответствия многочисленным приложениям. Уменьшая ход зеркал сканирования, можно увеличить плотность выборки за счет FOV, а добавляя больше областей бокового сканирования, можно увеличить FOV за счет увеличения объема.Например, рис. 4a – 4c показаны средние проекционные изображения и примеры нейронных следов из объема ∼600 × 600 × 500 мкм 3 в PTLp мыши, экспрессирующей jGCaMP7f 42 (см. Также фильм S6) при скорости звука ∼10 Гц и 1 Выборка латеральных вокселей в мкм, достаточная для определения субклеточных особенностей, таких как нейронные отростки активных клеток. Ослабление выборки вокселей до промежуточной латеральной выборки ∼3 мкм (рис. 4d – 4g, фильмы S7 и S7) позволяет увеличить объем записи до ∼2.0 × 2,0 × 0,5 мм 3 при частоте сбора данных 6,5 Гц, чтобы уловить активность популяции из ~ 70 000 нейронов у мышей с трансгенной меткой GCaMP6 при разрешении изображения выше, чем то, что необходимо для разрешения типичного кортикального слоя у мышей. нейроны.
Рис. 4: Многоуровневая функциональная визуализация с помощью микроскопии световых шариков.a – c , Объемное изображение высокого разрешения (∼600 × 600 × 500 мкм 3 ) нейроактивности при 9,6 Гц у мышей, экспрессирующих jGCaMP7f.Типичные средние проекционные изображения нейронов в плоскостях a 440 мкм и b 384 мкм, соответственно, взятые из вышеуказанного объема во время 3-минутной записи. Масштабные линейки: 50 мкм. Вставка с увеличенными областями, масштабные линейки: 10 мкм. См. Также Movie S6. c , репрезентативный временной ряд 9 нейронов, очерченных в увеличенной области плоскости в b. Смещение: 1.0 ΔF / F 0 . d – g , Запись 70 275 нейронов в объеме ∼2 × 2 × 0.5 мм 3 при 6,7 Гц и 2,8 мкм латеральной дискретизации вокселей. d , 3D-рендеринг извлеченных пространственных координат нейронов и максимальной прогнозируемой активности для 9-минутной записи. Поперечное изображение мозга воспроизведено из работы. 52. См. Также фильм S7. e, f Средние изображения проекции на глубине 144 и 482 мкм соответственно. Масштабные линейки: 250 мкм. Вставка с увеличенными областями, масштабные линейки: 50 мкм. См. Также Movie S8. г , репрезентативный временной ряд из 50 нейронов с усами. Возникновение раздражителя обозначено красными отметками.Смещение: 0,5 ΔF / F 0 .
Наконец, используя нашу оптимизированную выборку латеральных вокселей ∼5 мкм, мы можем получить изображение объема ∼5,4 × 6,0 × 0,5 мм 3 , охватывающего оба полушария неокортекса мыши до глубины ∼600 мкм в ткани (рис. 5, фильмы S9 и S10, 5,4 × 6 × 0,5 мм 3 FOV). В этой модальности мы демонстрируем визуализацию Ca 2+ популяций 0,8 — 1,1 миллиона нейронов с разрешением одного нейрона и частотой звука 2,2 Гц (3 записи, N = 3 мыши, рис.S7b). На рис. 5 показана репрезентативная запись 807 748 нейронов, на которых можно четко обнаружить одиночные переходные процессы кальция (рис. 5e, Movie S11). Оптический доступ, большая степень мультиплексирования и оптимизированный подход к сканированию, используемые LBM, открывают дверь к масштабированию 2pM от отдельных областей мозга до записи всей коры, что позволяет исследовать двухполушарную когнитивную обработку, а также захватывать отдельные пробная динамика популяций нейронов в головном мозге млекопитающих более чем на 2 порядка больше, чем при использовании любого другого метода. 10, 23, 25, 29
Рис. 5: Объемная запись 807 748 нейронов в пределах ∼5,4 × 6 × 0,5 мм 3 объема при 2,2 Гц у мыши, экспрессирующей GCaMP6s.a , 3D-рендеринг извлеченных пространственных координат нейрона и максимальной прогнозируемой активности для 9-минутной записи. Поперечное изображение мозга воспроизведено из работы. 53. См. Также фильм S9. b , Y-Z проекция плотности нейронов; примерные границы между корковыми слоями обозначены зелеными линиями; все значения глубины отображаются относительно pia. c , Среднее проекционное изображение по записи на глубине 600 мкм. Масштабная линейка: 500 мкм. Вставка: увеличено в области c , масштабная линейка: 200 мкм. См. Также Movie S10. d , Тепловая карта всех 807 748 извлеченных нейронов, нормализованная до максимального значения ΔF / F 0 . См. Также Movie S11. Подмножество из 10 примеров трассировок. Смещение: 1.0 ΔF / F 0 . e , подмножество 3000 трасс от c показано в полном разрешении. f , подмножество из 50 трасс от e .Смещение: 0,5 ΔF / F 0 .
Объемная химическая визуализация с помощью стимулированной проекционной микроскопии и томографии комбинационного рассеяния
Объемная визуализация на основе стимулированного комбинационного рассеяния
Обычно SRS-визуализация основана на двухмерном боковом сканировании сильно сфокусированных гауссовых лазерных лучей. Чтобы получить изображение через трехмерный объем, либо фокус лазера, либо образец необходимо перемещать в осевом направлении по одному изображению за шаг. Стек изображений, полученный по такой схеме, можно использовать для восстановления трехмерного объема, как показано на рис.1а. Для количественной оценки общего химического состава в объеме такая схема построения изображений с разделениями может потребовать много времени, особенно для большого объема, который требует восстановления множества срезов изображения. Луч Бесселя может оставаться сильно сфокусированным на большом расстоянии. Используя пучки Бесселя для возбуждения, сигнал ВКР может быть интегрирован в осевом направлении образца. Следовательно, сканирование пучков возбуждения Бесселя в двух измерениях на боковой плоскости может генерировать проекционное изображение, содержащее общее количество химических составов в объеме.Такой способ визуализации, называемый в данной статье SRP-микроскопией, проиллюстрирован на рис. 1b. Хотя микроскопия SRP позволяет проводить высокоскоростное количественное определение общего химического состава в объеме, она теряет осевое разрешение. Чтобы восстановить распределение химических компартментов в трехмерном объеме, мы дополнительно разработали томографию SRP, собирая серию изображений SRP при вращении образца и реконструируя трехмерную структуру с помощью алгоритмов восстановления изображения, как показано на рис. 1c.
Рис. 1: Режимы объемной визуализации на основе вынужденного комбинационного рассеяния света.( a ) Получение изображений в разрезе с помощью традиционной микроскопии с вынужденным комбинационным рассеянием света с гауссовым пучком. ( b ) Микроскопическое изображение с использованием стимулированной рамановской проекции (SRP) на основе пучков Бесселя. ( c ) Томографическая визуализация SRP на основе пучков Бесселя. ( d ) Генерация пучка Бесселя с помощью пары аксиконов и линзы объектива.
Теория генерации сигнала ВКР пучками Бесселя
Предполагая коллинеарно перекрывающиеся пучки накачки и Стокса, интенсивность ВКР от очень тонкой пластины с центром в позиции z и толщиной Δ z может быть выражена как ref.30
, где C 0 — постоянная, Im ( χ (3) ) — мнимая часть нелинейной восприимчивости третьего порядка χ (3) и I p ( z ) и I S ( z ) — интенсивности пучков накачки и Стокса при z соответственно.
Сообщалось о нескольких методах создания пучка Бесселя 31,32,33 . Здесь мы использовали два аксикона и линзу объектива для преобразования гауссова пучка в пучок Бесселя (рис.1г). В нашей реализации гауссов пучок сначала преобразовывался в кольцевой пучок парой аксиконов, а затем в пучок Бесселя через линзу объектива. Распределение интенсивности бесселевого луча можно смоделировать как
Здесь ( r , z ) — координаты в поперечном и продольном направлениях соответственно, I 0 — интенсивность в центре падающий гауссов пучок с полушириной w 0 « z B — эквивалентная длина Рэлея бесселевого пучка, r c — радиус кольцевого пучка, Δ d — ширина кольца, λ, — длина волны, а f — фокусное расстояние линзы объектива.
Выражая пучки накачки и Стокса с использованием выражения для пучка Бесселя в уравнении (2), мы получаем распределение интенсивности ВКР
, где C B , β p и β S — константы, P p ( z ) и P S ( z ) — мощности накачки и стоксова пучка соответственно, J 0 (·) — нулевая -порядок функции Бесселя.
Для толстого образца интенсивность сигнала SRP определяется как интегрирование I bSRS ( r , z ) по толщине образца L
Общий сигнал SRP тогда равен
Здесь A — это область интегрирования сигнала, а Q — эффективность обнаружения фотодетектора. Вывод уравнений (1, 2, 3, 4, 5) подробно описан в дополнительных примечаниях 1–3.
Результаты моделирования сигнала SRP
На основе уравнений (2 и 3) были рассчитаны распределения интенсивности полей накачки, Стокса и ВКР.Во всех расчетах использовался объектив A × 10 с числовой апертурой (NA) 0,3. Как показано на рис. 2a – d, наш подход может генерировать ограниченные боковой дифракцией бесселевские пучки как для полей накачки, так и для стоксовых полей, которые демонстрируют высокоинтенсивный центральный лепесток с серией низкоинтенсивных колец. Такой профиль луча может выдерживать большое расстояние в направлении распространения лазерного луча. Например, центральный лепесток стоксова луча (на длине волны 1040 нм) имеет поперечный диаметр 4,02 мкм (дополнительный рис.1a) и может выдерживать расстояние распространения более 8,89 мм при полной ширине на полувысоте (FWHM) 3,79 мм (дополнительный рисунок 1b). Хотя кольца накачки и стоксова пучка могут частично перекрываться (дополнительный рис. 2а), интенсивность лазера в кольцах намного ниже, чем в центральном лепестке. Таким образом, нелинейным сигналом SRP, генерируемым частично перекрывающимися кольцами, можно пренебречь (дополнительный рис. 2b). Разумно предположить, что сигнал SRP возникает только из перекрывающихся центральных лепестков бесселевых лучей (рис.2д, е).
Рис. 2: Численное моделирование распределения интенсивности бесселевого пучка и уровня сигнала вынужденной рамановской проекции.( a ) Поперечное и ( b ) продольное распределение интенсивности пучка накачки на длине волны 800 нм. Цветовая полоса такая же для a , b . ( c ) Поперечное сечение и ( d ) продольное распределение интенсивности стоксова пучка на длине волны 1040 нм.Цветовая полоса такая же для c , d . ( e ) Поперечное сечение и ( f ) продольные распределения интенсивности сигнала вынужденного комбинационного рассеяния (SRS), генерируемого около 2 885 см -1 . Цветовая полоса такая же для e , f . ( g ) Вынужденная рамановская проекция (SRP) и уровень сигнала SRS как функция толщины образца, предполагая, что входная мощность лазера одинакова для бесселевого и гауссова пучков.( h ) SRP и уровень сигнала SRS как функция толщины образца, предполагая одинаковую мощность лазера в центральном лепестке бесселевого луча и полную мощность гауссова луча. Красные сплошные кривые показывают сигнал SRP, генерируемый бесселевской накачкой и стоксовым пучком, а синие пунктирные кривые показывают сигнал SRS, генерируемый гауссовой накачкой и стоксовым пучком.
На рис. 2g, h показан уровень сигнала SRP как функция толщины образца, помещенного в центр фокуса, рассчитанный с использованием уравнения (5).Обнаружена линейная зависимость сигнала SRP от толщины образца в пределах 2,2 мм. Если толщина образца превышает 2,2 мм, такая линейность нарушается. Это связано с тем, что 2,2 мм — это продольная FWHM сигнала SRP. Мощность пучка Бесселя равномерно распределяется на центральный лепесток и кольца. Следовательно, плотность энергии в фокусе бесселевого пучка часто намного ниже, чем у гауссова пучка с той же общей входной мощностью. Следовательно, сигнал SRP, генерируемый пучками Бесселя, может быть намного ниже, чем сигнал SRS, генерируемый гауссовыми пучками, особенно когда образец тонкий (рис.2г). Для толстого образца сигнал от SRP может быть сравнимым или даже большим, чем сигнал SRS, генерируемый гауссовыми лучами, из-за большой длины интегрирования сигнала. Если мы предположим, что мощность в центральном лепестке бесселевого луча равна мощности в гауссовом фокусе, сигнал SRP, генерируемый бесселевыми лучами, всегда больше, чем сигнал SRS от гауссовых лучей (рис. 2h).
Далее мы рассчитали зависимость сигнала SRP от мощности лазера, которая показала положительный линейный рост, как видно на дополнительном рис.3. Мы также исследовали влияние числовой апертуры объектива и увеличения на рэлеевскую длину бесселевского луча, размер центрального лепестка, общий сигнал SRP и продольную FWHM сигнала SRP. Как показано на дополнительном рисунке 4, больший сигнал SRP может быть получен с помощью объективов с меньшим увеличением и большей числовой апертурой. Кроме того, для конкретной NA сигнал SRP уменьшался с большим увеличением. Однако для конкретного увеличения было оптимальное значение NA для генерации максимального сигнала SRP для каждой толщины образца.Кроме того, мы обнаружили, что и рэлеевская длина бесселевого луча (дополнительный рис. 5a), и продольная FWHM сигнала SRP (дополнительный рис. 5b) уменьшались с большим увеличением (зафиксируйте значение NA) или NA (зафиксируйте значение NA) значение увеличения). Для бесселевой микроскопии SRP размер центрального лепестка определяет разрешение системы, которое не зависит от величины увеличения (дополнительный рис. 6a), но обратно зависит от значения числовой апертуры (дополнительный рис. 6b). Результаты нашего моделирования могут помочь выбрать оптимальную цель для конкретных приложений визуализации SRP.
Микроскоп SRP
Схема нашего микроскопа SRP изображена на рис. 3. Два синхронизированных луча генерировались импульсным лазером (InSight DeepSee, Spectral Physics) с частотой следования 80 МГц. Один луч имел фиксированную длину волны 1040 нм и использовался в качестве стоксова луча. Другой луч имел настраиваемую длину волны от 680 до 1300 нм и использовался в качестве луча накачки. Стоксов пучок модулировался на частоте 2,5 МГц с помощью акустооптического модулятора (1205-C, Isomet). Луч накачки сначала задерживался поступательным каскадом, а затем пространственно и временно объединялся с пучком Стокса с помощью дихроичного зеркала.Два аксикона (AX2520-B, Thorlabs) использовались для преобразования перекрывающихся гауссовых лучей в кольцевые лучи. После уменьшения размера луча с помощью системы линз 4- f кольцевые лучи направлялись в 2D-гальваническую систему (GVS012, Thorlabs) для лазерного сканирования. После отражения двухмерной гальванической системой и расширения с помощью другой системы линз 4- f сканированные кольцевые лучи направлялись на линзу объектива для генерации лучей Бесселя.
Рис. 3: Экспериментальная установка стимулированного рамановского проекционного микроскопа и томографического изображения.Перестраиваемый импульсный лазер обеспечивает две синхронизированные последовательности фемтосекундных импульсов в качестве пучка накачки и стоксова пучка. Пучок Стокса модулируется АОМ. Луч накачки сначала задерживается поступательным каскадом, а затем пространственно и временно объединяется с пучком Стокса с помощью DM. Коллинеарно перекрывающиеся лучи направляются на пару аксиконов для создания кольцевых лучей. Регулируя размер луча, кольцевые лучи сначала направляются в двухмерную гальваническую систему для лазерного сканирования, а затем направляются к объективу для генерации бесселевых лучей.После пробы прошедшие пучки Бесселя собираются конденсатором и затем направляются на ФД. Пара короткопроходных фильтров закреплена перед ФД для удаления состава стоксова пучка. Фототок, генерируемый в PD, усиливается резонансным усилителем, созданным в лаборатории, и затем направляется на синхронизирующий усилитель для извлечения сигнала. А, аксикон; АОМ — акустооптический модулятор; DM — дихроичное зеркало; HWP, полуволновая пластина; L, линза; М, зеркало; PBS, поляризационный светоделитель; ПД, фотодиод.
Система линз 4- f была создана для создания сопряженной плоскости гальванической системы на входе в объектив и для расширения кольцевых лучей, чтобы они соответствовали входному зрачку линзы объектива.После образца мы использовали водный иммерсионный объектив × 60 (UPlanSApo × 60, NA = 1,2, Olympus) для сбора прошедших лучей Бесселя. Такой объектив с высокой числовой апертурой обеспечивал высокую эффективность сбора сигналов, предотвращая перекрестную фазовую модуляцию фона изображения. Переданные лучи сначала фильтровались парой короткопроходных фильтров (ET980SP-2P, Chroma) для удаления состава стоксова луча, а затем направлялись на кремниевый фотодиод большой площади (S3994-01, Hamamatsu). Фототок, генерируемый фотодиодом, сначала усиливался лабораторным резонансным усилителем, а затем отправлялся на синхронизирующий усилитель (SRS844, Stanford Research Systems или MFLI, Zurich Instruments) для дальнейшего усиления и извлечения сигнала.
Чтобы облегчить сравнение между микроскопом SRS с гауссовым лучом и микроскопом SRP с бесселевым лучом, мы построили дополнительную оптическую руку, чтобы позволить лазерным лучам обходить аксиконы, как показано пунктирными линиями на рис. 3. С помощью перевернутых зеркал , система может быстро переключаться между схемами Бесселя SRP и гауссовой SRS.
Характеристики микроскопа SRP
Сначала мы проверили результаты моделирования пучков Бесселя с использованием объектива × 10 с NA = 0,3.Для стоксова луча на длине волны 1040 нм диаметр центрального лепестка и осевая полуширина продольного распространения были измерены и составили 4,13 мкм и 3,34 мм соответственно (дополнительный рисунок 7). Эти значения полностью совпадают с расчетами.
Далее мы охарактеризовали работу микроскопа SRP. Для исследования зависимости сигнала SRP от толщины образца и входной мощности лазера были приготовлены пленки полидиметилсилоксана (PDMS) различной толщины.На рисунке 4а показано, что сигнал SRP линейно возрастает с увеличением толщины образца в миллиметровом диапазоне ( R 2 = 0,9977). Кроме того, сигнал SRP линейно зависел от мощности как накачки ( R 2 = 0,9998), так и стоксова ( R 2 = 0,9980) лучей (рис. 4b, c). Шум, с другой стороны, был пропорционален квадратному корню из мощности накачки (рис. 4d), что указывало на обнаружение сигнала, ограниченного дробовым шумом лазера.
Рис. 4. Характеристика проекционного микроскопа со стимулированным комбинационным рассеиванием.( a ) Измеренный сигнал вынужденной рамановской проекции (SRP) от пленок PDMS как функция толщины образца. Красная линия — это линейная аппроксимирующая кривая для измеренных точек данных ( R 2 = 0,9977). ( b , c ) Сигнал SRP PDMS в зависимости от мощности Стокса ( b ) и мощности накачки ( c ). Красные линии — это линейные аппроксимирующие кривые для измеренных точек данных ( R 2 = 0.9980 для мощности Стокса и R 2 = 0,9998 для мощности накачки). ( d ) Шум SRP как функция мощности накачки. Красная кривая — результат аппроксимации измеренных точек данных ( R 2 = 0,9931). ( e ) Отношение сигнал / шум (SNR) микроскопии SRP как функция концентрации образца. Красная линия — это линейная аппроксимация точек измеренных данных ( R 2 = 0,9994). ( f ) Спектр SRP ДМСО в D 2 O при концентрации 21.84 мМ.
Затем мы оценили чувствительность микроскопа SRP, измерив симметричное растяжение CH 3 при 2915 см -1 для диметилсульфоксида (ДМСО), разбавленного оксидом дейтерия (D 2 O). Толщина образца составляла 2 мм, что меньше продольной FWHM пучков Бесселя, генерируемых объективом × 10. Мощность накачки и Стокса на центральном лепестке бесселевых пучков составляла 0,7 и 30 мВт соответственно. На рис. 4e показано измеренное отношение сигнал / шум в зависимости от концентрации ДМСО.Эти результаты показали предполагаемый предел обнаружения 21,84 мМ ДМСО при одночастотном измерении SRP. Из измерения спектра, которое может еще больше повысить чувствительность системы, мы можем четко выделить пик от 21,84 мМ ДМСО (рис. 4f) и достичь предела обнаружения 1,8 мМ ДМСО. Мы также измерили рамановский переход C = C на расстоянии 1583 см -1 от ретиноевой кислоты, что дало предел обнаружения всего 100 мкМ (дополнительный рис. 8). Этот результат подтвердил микромолярную чувствительность нашего микроскопа SRP в области рамановских отпечатков пальцев.
Микроскопическое изображение SRP
Чтобы доказать способность нашего микроскопа SRP быстро определять количество химических веществ в объеме, мы визуализировали полистирольные шарики, диспергированные в трехмерной матрице агарозного геля, и сравнили изображения SRP с изображениями SRS-срезов, полученными по гауссовой схеме. . Из изображений SRS с гауссовым пучком можно увидеть только часть гранул в каждой плоскости сечения (рис. 5а). Чтобы отобразить все шарики в трехмерном объеме, в течение 20 секунд была получена серия секционных изображений (50 изображений, 2 мкм на шаг, как показано в дополнительном фильме 1).Наложение разрезов изображений с выбранных глубин показано на рис. 5b. На изображении SRP, полученном в том же месте, все частицы в объеме могут быть разрешены с помощью одного двухмерного бокового сканирования, завершенного за 2 с (рис. 5c, d), что на порядок быстрее, чем получение изображения в разрезе. Такое преимущество в скорости может быть увеличено для получения изображения еще большего объема. Мы также визуализировали смесь шариков из полистирола диаметром 10 и 100 мкм (дополнительный рис. 9). Было обнаружено, что интенсивность сигнала SRP от бусинок 100 мкм примерно в 10 раз выше, чем у бусинок 10 мкм (оба измерены в центральной части бусинок).Этот результат еще раз подтвердил пригодность нашего микроскопа SRP для количественной химической оценки.
Рис. 5. Объемное изображение шариков из полистирола.( a ) Сечения изображений, полученных с помощью микроскопа с гауссовым пучком стимулированного комбинационного рассеяния (ВКР) на разных глубинах объема образца. ( b ) Наложение секционных изображений в a . Искусственными цветами изображены бусинки, расположенные на разной глубине. Изображения одних и тех же гранул с помощью стимулированной рамановской проекции (SRP), полученные при включенном ( c ) и выключенном ( d ) резонансе комбинационного рассеяния.Время пребывания пикселя составляло 10 мкс для изображения SRS и 50 мкс для изображения SRP. Масштабные линейки 30 мкм.
В качестве примера для количественной оценки биомолекул мы визуализировали липидные капли (LD) в дифференцированных клетках 3T3-L1. Мы настроили рамановский переход на симметричное колебание CH 2 на высоте 2850 см -1 , чтобы отобразить ЛД. Клетки имеют форму, близкую к сферической, диаметром до десятков микрометров. Сначала мы получили 50 изображений клеток в разрезе с помощью микроскопа SRS с гауссовым лучом с шагом 1 мкм на глубину.Общее время получения изображения 45 с. На рис. 6а показаны изображения в разрезе на глубине z = 20, 30 и 40 мкм, демонстрирующие очень разные внутриклеточные морфологии LD. На рис. 6b показано наложение 50 изображений в разрезе, представляющих общее содержание липидов в клетке. С другой стороны, SRP-изображение той же клетки напрямую выявило такую глобальную информацию о липидах с помощью одного двухмерного бокового сканирования, выполненного всего за 0,9 с (рис. 6c, d), давая морфологию и профиль интенсивности, аналогичные профилям суперпозиции. изображение (рис.6б). Этот пример дополнительно подчеркнул преимущество скорости использования микроскопии SRP для количественной оценки глобальной информации о биомолекулах в объеме.
Рис. 6: Объемное изображение одной жировой клетки.( a ) Изображения в разрезе, полученные с помощью микроскопа вынужденного комбинационного рассеяния света (ВКР) с гауссовым пучком на разной глубине образца. ( b ) Наложение 50 секционных изображений. Изображения стимулированной рамановской проекции (SRP) одной и той же ячейки, полученные при включенном ( c ) и выключенном ( d ) резонансе комбинационного рассеяния.Время пребывания пикселя составляло 10 мкс для изображений SRS и SRP. Профили сигналов по пунктирным линиям отображались в правом нижнем углу изображений. Масштабные линейки 30 мкм.
Томографическая визуализация SRP
Хотя микроскопия SRP может количественно определять химические вещества или биомолекулы в объеме с высокой скоростью, она теряет осевое разрешение. Чтобы устранить это ограничение, мы разработали томографический метод на основе SRP для восстановления трехмерного распределения биомолекул в объеме с оптическим разрешением.В этом томографическом методе проекционные изображения собирались при повороте образца на 1 ° на шаг в течение 180 шагов. Затем 180 проекционных изображений были собраны для восстановления трехмерной информации в объеме изображения. Сначала мы написали код реконструкции, а затем проверили код с помощью моделирования. Имитационная модель содержала четыре объекта, которые генерировали сигналы, как показано на дополнительном рисунке 10. Стек изображений SRP был сформирован путем вращения образца вокруг главной оси цилиндрического объема (вдоль направления z ) при проецировании объектов на плоскость. по оси.Затем местоположение и распределение объектов были восстановлены из стека изображений SRP с помощью алгоритма отфильтрованной обратной проекции (FBP) 34 . Восстановленный трехмерный объем и соответствующие изображения поперечного сечения из поперечного, коронарного и сагиттального видов показаны в дополнительном фильме 2 и дополнительном рисунке 11, демонстрируя хорошее согласие с исходными объектами (дополнительный рисунок 10).
Экспериментально мы визуализировали трехмерное распределение шариков полиметилметакрилата (ПММА) (10 мкм) в агарозном геле.Лазер был настроен на возбуждение рамановского перехода на высоте 2950 см -1 от колебания CH 3 . Образец загружали в цилиндрическую капиллярную трубку (диаметром 50 мкм), закрепленную на вращающемся столике. Образец последовательно поворачивали на 180 ° с шагом 1 ° за шаг. Затем на каждом этапе собирали SRP-изображения шариков. Реконструированный объем имел размер около 60 × 60 × 60 мкм 3 . На восстановленном томографическом изображении размер и расположение шариков были хорошо разрешены (дополнительный фильм 3).Кроме того, достоверность томографической реконструкции была подтверждена с помощью восстановленного объема из изображений сечений, полученных с помощью SRS сечения изображения на тех же гранулах с помощью гауссова луча. Восстановленный трехмерный объем шариков ПММА с помощью сечения изображений показан в дополнительном фильме 4. Для прямого сравнения мы выбрали соответствующие срезы (в корональной и сагиттальной проекциях) шариков, визуализированных с использованием обоих методов, как показано на рис. 7 Хотя пространственное разрешение несколько снизилось, результаты томографии SRP хорошо согласуются с результатами визуализации SRS срезов с точки зрения морфологии и локализации.Сферическую форму шариков можно хорошо реконструировать с небольшими искажениями, что было доказано путем сравнения профилей шариков по трем осевым направлениям, как показано на дополнительном рис. 12.
Рис. и получение изображений в разрезе с использованием стимулированного комбинационного рассеяния.( a , b ) Выбранные срезы изображений шариков из ПММА в различных положениях в сагиттальной проекции (плоскость yz ).( c , d ) Выбранные фрагменты изображения из тех же гранул в корональной проекции (плоскость xz ). ( a , c ) Изображения, восстановленные с помощью томографии с использованием стимулированной рамановской проекции (SRP). ( b , d ) Сечения изображений, полученных с помощью микроскопа с гауссовым пучком стимулированного комбинационного рассеяния (SRS). Полученный объем составлял ∼60 × 60 × 50 мкм 3 для SRS сечения изображения и 60 × 60 × 60 мкм 3 для томографического изображения SRP.Время пребывания пикселя составляло 10 мкс для SRS сечения изображения и 24 мкс для томографического изображения SRP. Шкала 10 мкм.
Томография SRP имеет большее преимущество в скорости визуализации при измерении большего объема. В качестве примера мы изобразили шарик полистирола размером 100 мкм в объеме ∼320 × 320 × 320 мкм 3 . Восстановленный трехмерный объем с помощью томографии SRP показан в дополнительном фильме 5. Точность восстановления томографии SRP была снова подтверждена сравнением одного из трехмерных изображений в разрезе с соответствующим изображением, полученным с помощью SRS-изображения с помощью гауссова луча (дополнительный рис.13). При использовании томографии SRP потребовалось 47 с для получения стопки изображений SRP из 180 проекций. Однако при использовании метода построения изображений с использованием SRS с использованием гауссова луча требуется 723 сечения, что составляет 188 с, чтобы получить трехмерное изображение такого большого объема. В этом случае наша томография SRP выполняется в четыре раза быстрее, чем метод секционирования. Для получения изображений еще большего объема, когда требуется больше изображений в разрезе для восстановления объемной структуры, преимущество томографии SRP в скорости визуализации будет еще больше проявлено.Отметим, что скорость изображения, рассчитанная здесь, рассчитана для одного рамановского сдвига. Регулируя длину волны луча накачки, можно визуализировать различные рамановские сдвиги. Настройка лазера может быть достигнута за десятки миллисекунд в диапазоне 200 см -1 или за секунды в большем диапазоне в 4 000 см -1 (ссылка 35).
Затем мы выполнили томографию SRP на отдельных дифференцированных клетках 3T3-L1, чтобы изучить потенциал этого метода для 3D in vivo визуализации биомолекул.Лазер был настроен на возбуждение вибрации CH 2 на высоте 2850 см -1 . На рис. 8a показано реконструированное трехмерное распределение липидов в клетке, а полное трехмерное изображение отображается в дополнительном фильме 6. Выбранные срезы на сагиттальном и поперечном представлениях отображают различные распределения липидов и показаны на рис. 8b, c, соответственно. . Такое распределение липидов также было выявлено на изображениях сечения SRS в поперечном виде (дополнительный рисунок 14), показывая хорошее согласие с результатами томографии, за исключением небольших различий в тонких структурах, возможно, вызванных различиями в разрешении системы, несоответствиями в глубине изображения и несогласованностью. в ориентации образца.Пространственное разрешение томографических изображений SRP было немного ниже, чем у изображений в разрезе SRS, что вызвано более низкой эффективной числовой апертурой при измерении SRP (∼0,88 в SRP Бесселя и ∼1,07 в SRS по Гауссу). Эти результаты подтвердили применимость томографии SRP для in vivo визуализации биомолекул в трехмерном объеме.
Рис. 8: Объемное изображение одной жировой клетки с помощью проекционной томографии со стимулированным комбинационным рассеиванием.( a ) Реконструированная трехмерная структура ячейки 3T3-L1.( b ) Выбранные срезы изображения ячейки 3T3-L1 в разных положениях в сагиттальной проекции (плоскость yz ). ( c ) Изображения из той же ячейки в поперечном виде (плоскость xy, ). Изображаемый объем составлял ∼150 × 150 × 150 мкм 3 . Время пребывания пикселя составляло 10 мкс. Масштабные линейки, 20 мкм.
Многоклеточная многоцветная визуализация со сверхвысоким разрешением с использованием объемной мультифокусной микроскопии
Значение
Основной проблемой современных биологических исследований является определение трехмерной молекулярной архитектуры клеточных органелл.В последние годы значительный прогресс в наноразмерной визуализации был достигнут благодаря появлению оптической микроскопии сверхвысокого разрешения. Однако многие методы сверхвысокого разрешения по-прежнему ограничиваются сбором 2D. Здесь мы демонстрируем объемный подход к визуализации сверхвысокого разрешения, основанный на одновременном отображении нескольких плоскостей образца с помощью мультифокальной микроскопии. Глубина, на которой могут быть реконструированы структуры, достигает 4 мкм, что сравнимо с толщиной многих клеточных органелл или даже целых клеток.
Abstract
Визуализация сверхвысокого разрешения на основе одиночных молекул стала важным инструментом в современной клеточной биологии. Из-за ограниченной глубины резкости систем оптической визуализации одна из основных проблем при визуализации со сверхвысоким разрешением заключается в захвате трехмерной наноразмерной морфологии всей клетки. Несмотря на многие предыдущие попытки расширить применение методов фотоактивированной микроскопии локализации (PALM) и микроскопии стохастической оптической реконструкции (STORM) в трех измерениях, эффективная глубина локализации обычно не превышает 1.2 мкм. Таким образом, трехмерная визуализация целых клеток (или даже крупных органелл) по-прежнему требует последовательного получения изображений в различных аксиальных положениях и, следовательно, страдает от комбинированных эффектов активации расфокусированных молекул (повышенный фон) и обесцвечивания (потеря обнаружения). Здесь мы представляем использование многофокусной микроскопии для получения объемных многоцветных изображений со сверхвысоким разрешением. За счет одновременной визуализации девяти различных фокальных плоскостей мультифокусный микроскоп мгновенно фиксирует распределение отдельных молекул (флуоресцентных белков или синтетических красителей) в объеме глубиной ∼4 мкм с точностью латеральной и осевой локализации ∼20 и 50 нм соответственно. .Возможности мультифокусной микроскопии быстро отображать трехмерную организацию внутриклеточных структур иллюстрируются визуализацией митохондриальной сети млекопитающих и микротрубочек дрожжей во время деления клеток со сверхвысоким разрешением.
Из-за своей специфичности и способности отображать живые образцы флуоресцентная микроскопия является наиболее широко используемым инструментом визуализации для биологических исследований. В последние годы было внедрено несколько методов повышения разрешающей способности флуоресцентной микроскопии за пределами дифракционного предела (1, 2).Эти методы включают истощение стимулированного излучения (3), структурированное освещение (4) и микроскопию локализации одиночных молекул (LM) (5, 6). В последнем подходе точный контроль условий освещения делает возможной редкую активацию отдельных флуоресцентных молекул, позволяя определять их положение с точностью до нескольких десятков нанометров. Последовательная фотоактивация, визуализация и обесцвечивание (или фотопереключение) большого количества флуорофоров затем позволяют реконструировать исследуемую структуру, воплощая принципы фотоактивированной локализационной микроскопии (PALM) (5), флуоресцентной фотоактивационной микроскопии локализации (FPALM). ) (7) и микроскопии стохастической оптической реконструкции (STORM) (6, 8).
LM-методы вызвали значительный интерес в биологических исследованиях (9, 10), но по-прежнему преимущественно реализуются с использованием микроскопии с затухающими волнами (или флуоресцентной микроскопии полного внутреннего отражения) (11), что ограничивает их применение двумерными или тонкими структурами, близкими к клетке. мембрана. Однако во многих биологических контекстах очень желательно получить доступ к трехмерной внутриклеточной организации клетки с субдифракционным разрешением.
Для эффективного 3D LM в культивируемых клетках необходимо решить две проблемы.Во-первых, одиночные молекулы должны быть локализованы с субдифракционной точностью как в латеральном, так и в осевом направлении. Во-вторых, осевая глубина, на которой выполняются локализации, должна быть сопоставима с толщиной всей клетки. Подходы, разработанные для решения первой проблемы, обычно основываются на шифровании осевой информации в 2D-изображениях путем разработки функции рассеяния точки (PSF) микроскопа (8, 12⇓⇓ – 15), однофотонной интерферометрии (16) или биплановой визуализации. (17⇓ – 19). Однако типичная глубина визуализации большинства этих методов не превышает 1.2 мкм и, следовательно, недостаточно для визуализации целых клеток. Кроме того, из-за конфигурации возбуждения с широким полем, преимущественно используемой для визуализации в 3D LM, активация и испускание расфокусированных молекул приводит к увеличению фона на флуоресцентном изображении и их ненужному обесцвечиванию (Рис. 1 A и В ). Другими словами, информация за пределами плоскости формирования изображения теряется, в то время как отношение сигнал / шум в изображении снижается. Селективное возбуждение плоскости (20) или активация (21, 22) может обойти эту проблему, но требует последовательного сканирования для изображения всего объема клетки.
Рис. 1.Сравнение между обычным широкопольным детектированием и мультифокусным детектированием. ( A и B ) Весь объем возбуждается в конфигурации с широким полем, и флуоресценция расфокусированных молекул составляет фон зарегистрированного сфокусированного сигнала. ( C и D ) В мультифокусной конфигурации трехмерная протяженность PSF используется для локализации молекул в объеме, поскольку информация получается из нескольких фокальных плоскостей.
Мы сообщаем об успешной реализации объемного метода сверхразрешения PALM / STORM, который позволяет избежать вышеупомянутых проблем. Наш метод основан на недавно разработанном мультифокусном микроскопе (MFM) (23), который обеспечивает одновременное получение девяти равноотстоящих фокальных плоскостей (рис.1 C и D ) на одной камере за счет комбинации специальной дифракционной решетки. и элементы хроматической коррекции, размещенные в эмиссионном тракте микроскопа (рис.2). Расстояние между последовательными фокальными плоскостями составляет ~ 440 нм, что обеспечивает точную трехмерную локализацию одиночных флуоресцентных молекул с трехмерной гауссовой аппроксимацией полученных PSF. Мы показываем, что такое объемное получение совместимо с двухцветной визуализацией PALM / STORM со сверхвысоким разрешением клеток млекопитающих и дрожжей с точностью латеральной и осевой локализации ~ 20 и 50 нм, соответственно. Глубина визуализации составляет ~ 4 мкм, что значительно превышает возможности других методов трехмерного сверхразрешения (обзор в ссылке 24), и, в частности, позволяет получить полное трехмерное изображение многих клеточных органелл или целых клеток (фильмы S1 и S2).
Рис. 2. УстановкаMFM. Лазеры возбуждения объединены в волокне через акустооптический перестраиваемый фильтр, коллимированы, отражены на дихроичном зеркале (DM) и сфокусированы на задней апертуре высокоинтенсивного NA. цель — добиться возбуждения в широком поле. Собранное излучение проходит через DM и проходит через MFG, расположенный в плоскости, сопряженной с плоскостью заднего зрачка объектива. Порядки дифракции проходят через модуль хроматической коррекции, а затем отдельно фокусируются на детекторе.Для регистрации дрейфа образца и предметного столика гранулы полистирола (диаметром 4 мкм) были иммобилизованы на покровном стекле, освещены инфракрасным светоизлучающим диодом (IR LED), и их дифракционная картина была записана с помощью инфракрасной камеры (IR CAM) через дополнительный светоделитель, вставленный в тракт излучения. Графики представляют собой записанные положения борта по осям x и z . ( Нижняя вставка ) Пример испускания молекул, записанных в различных плоскостях z , соответствующих меченым нуклеопорам (необработанные данные находятся в Movie S1, а восстановленное изображение — в Movie S2).(Шкала: 5 мкм.)
Результаты
Точность локализации.
Сначала мы исследовали зависимость точности локализации от расстояния между последовательными плоскостями при использовании MFM. Для этого были получены изображения флуоресцентных шариков с длиной волны 200 нм, иммобилизованных на покровном стекле, с использованием четырех различных мультифокусных решеток (MFG), соответствующих межплоскостному расстоянию (Δz) 110, 220, 440 и 880 нм (при λ = 670 нм) ( Рис.3 A ). Столик микроскопа сдвигался с шагом 60 нм (120 нм для случая шага 880 нм) вдоль оптической оси, и за один шаг снималось 20 кадров (рис.3 В ). Интенсивность возбуждения и параметры получения изображения были отрегулированы так, чтобы сигнал шарика был сравним с сигналом отдельного флуорофора при получении PALM / STORM. Для каждого кадра сигнал был подогнан трехмерной интегрированной функцией Гаусса ( SI Text и рис. S1), и SD оцененных положений вычислялось для каждого шага. Для всех решеток с Δz менее 500 нм мы наблюдали, что точность осевой локализации была менее 50 нм на полной (9 × Δz) глубине изображения (рис.3 C и рис. S2).
Рис. 3.Характеристика 3D MFM. ( A ) Относительное положение в фокусе последовательных плоскостей z для образца дифракционных решеток MFM, испытанных на расчетной длине волны 515 нм. Подтверждено, что расстояние составляет 880, 440, 220 и 110 нм для решеток I, II, III и IV соответственно. ( B ) Измерения осевого положения флуоресцентных шариков 200 нм по сравнению со смещением пьезоэлектрического столика. Было получено 20 кадров в каждой позиции предметного столика, и локализация валика по оси z была выполнена, как описано в тексте.Превосходное соответствие между положением столика и экспериментально обнаруженной локализацией шарика очевидно в диапазоне ~ 4 мкм при использовании решетки II (расстояние 440 нм). ( C ) SD осевой локализации флуоресцентных шариков в зависимости от положения z , записанное с помощью решеток с различным шагом. ( D ) Относительные положения в фокусе последовательных плоскостей z измеряются для решетки II на трех разных длинах волн. ( Врезка ) Зависимость расстояния между плоскостями этой решетки от длины волны.( E ) Распределение точности латеральной локализации (SD) флуоресцентных шариков, отображаемых в 2D-конфигурации с широким полем с использованием 2D-подгонки по Гауссу (среднее значение = 2,6 нм). ( F ) Распределение точности латеральной локализации одних и тех же шариков, отображаемых в конфигурации MFM и локализованных с помощью двумерной подгонки по Гауссу с использованием только одной (в фокусе) плоскости изображения (среднее значение = 13 нм). ( G ) Распределение точности латеральной локализации, полученное с помощью трехмерной гауссовой аппроксимации того же изображения MFM, что и в F (среднее значение = 9 нм).
Для получения многоцветных изображений со сверхвысоким разрешением решетка MFM используется на длинах волн, отличных от проектного значения (∼515 нм), что влияет на общую дифракционную эффективность и однородность между порядками дифракции. На практике первый эффект приводит к умеренному снижению отношения сигнал / шум, тогда как последний эффект может быть компенсирован с помощью процедуры после сбора данных ( Methods , System Calibration and Data Analysis ). Кроме того, использование дифракционных решеток приводит к хроматической дисперсии, которая, если ее не учитывать, может привести к хроматической аберрации.Хотя поперечная хроматическая дисперсия эффективно корректируется с помощью светящейся решетки и призмы, размещенных после MFG вдоль пути излучения, осевая хроматическая дисперсия проявляется как изменение эффективного Δz между последовательными плоскостями.
В плоскости Фурье системы формирования изображения волновой фронт света на длине волны λ, исходящий от излучателей, расположенных на осевом расстоянии Δz от фокальной плоскости в среде с показателем преломления n λ , характеризуется фазой профиль сдвига, масштабируемый как (2π / λ) nλΔz (25).Искажение MFG действует на волновой фронт излучения, чтобы уравновесить этот профиль фазового сдвига (23). Индуцированный фазовый сдвиг масштабируется как (2π / λ) nλaΔz ( a — целое число от -4 до +4, характерное для порядка дифракции). Осевое положение Δz и длина волны включены в конструкцию решетки. Получение изображений на другой длине волны приводит к небольшому изменению скорректированного профиля фазового сдвига, который, в свою очередь, соответствует другому осевому положению. Как показано экспериментально на рис.3, для данной решетки эффективная Δz линейно масштабируется с длиной волны ( SI Text имеет полный аналитический вывод).
Для достижения совместной регистрации различных спектральных каналов, многоцветные шарики визуализировались последовательно через разные фильтры во время пошаговых осевых смещений. Затем были вычислены отдельные матрицы пространственного преобразования Δz и дифракционная эффективность, которые использовались в качестве калибровки для повторного выравнивания стопок изображений в различных спектральных каналах.Мы оцениваем общую точность регистрации двух цветов как лучше, чем 10 нм в латеральном направлении и 30 нм в осевом направлении ( SI Text и рис. S3 и S4).
По сравнению с отображением одной плоскости, неизбежным недостатком многоплоскостного обнаружения является более низкое отношение сигнал / шум, поскольку общее количество фотонов разделено между различными плоскостями изображения. Из-за потерь, вызванных элементами мультифокальной решетки (дифракционная эффективность 65%) и хроматической коррекции (эффективность 85% на длине волны изображения), мы оцениваем, что ∼5% испускаемых фотонов детектируется в каждой из девяти плоскостей (на длине волны 670 нм). длина волны).Таким образом, SD положения бокового излучателя, как ожидается, увеличится на 20. Чтобы исследовать последствия разделения сигнала, мы визуализировали флуоресцентные шарики на нескольких сотнях кадров с использованием MFM, а также с одноплоскостной конфигурацией, где все возбуждение и параметры сбора были идентичны. Мы сравниваем SD латеральной локализации для обоих сценариев на рис. 3 E – G . Как и ожидалось, расщепление значительно снижает точность латеральной локализации, когда плоскости анализируются по отдельности (рис.3 E в сравнении с рис. 3 F ). Тем не менее, MFM позволяет выполнять выборку PSF в различных фокальных плоскостях z , что эффективно улучшает боковую SD на квадратный корень из числа плоскостей выборки. При интервале 440 нм PSF обычно отображается в двух плоскостях, что указывает на улучшение на 2, что было подтверждено экспериментально на рис. 3 G . Поэтому шаг решетки 440 нм был выбран как хороший компромисс между точностью и глубиной изображения (∼4 мкм) (рис.3 С ).
Визуализация сети митохондрий в клетках HeLa.
Чтобы проверить надежность и производительность 3D-микроскопии сверхразрешения MFM, мы сначала применили ее к визуализации STORM митохондрий в клетках HeLa, трансфицированных TOM20 (транслоказой внешней митохондриальной мембраны), слитой с GFP. После фиксации параформальдегидом (PFA) TOM20-GFP был помечен конъюгатом нанотело анти-GFP – Alexa 647 (26) в присутствии поглотителя кислорода ( SI Text ). Для достижения разреженного обнаружения (∼0.08 молекул / мкм 2 на кадр), использовался маломощный 488-нм (или 405-нм) лазер вместе с мощным 640-нм лазерным освещением (1 кВт / см 2 ). Поскольку для получения изображений в STORM требуется сбор данных в течение длительного времени (∼15 мин), мы скорректировали тепловой дрейф микроскопа. С этой целью мы использовали изготовленную на заказ систему отслеживания образца, которая анализирует дифракционные кольца шарика размером 4 мкм, прикрепленного к покровному стеклу образца, и находит его центр с точностью до 1 нм в диапазонах x / y и 5 нм. в z (27, 28) (рис.S5 – S7). На рис. 4 показано типичное сверхразрешенное изображение митохондрий на глубине ∼4 мкм, реконструированное с локализацией ∼10 6 молекул, обнаруженных более чем на 30 000 кадров. Обратите внимание, что сопоставимые глубины визуализации недостижимы с помощью других методов, если не используется последовательное сканирование z в сочетании с селективным освещением плоскости (20, 21). Чтобы напрямую оценить точность локализации для отдельных красителей Alexa 647 (связанных с белками TOM20) в наших условиях визуализации и образцов, мы выделили одиночные молекулы, которые распространились на несколько последовательных кадров.Мы обнаружили, что точность локализации составляла 16 нм по латерали и 35 нм по оси в диапазоне глубины обнаружения ( SI Text и рис. S8 – S10). Изображение, полученное с помощью программы трехмерной реконструкции / визуализации со сверхвысоким разрешением ViSP (29), показывает сильно взаимосвязанную пространственную сеть митохондрий, которая особенно плотно прилегает к ядру клетки (рис. 4 C , нижний левый угол и фильмы S3– S5). Из-за непрерывного деления и слияния в живых митохондриях такие сети постоянно меняют свою форму; Точность локализации 3D MFM была достаточной, чтобы четко различить внешнюю мембрану митохондрий в латеральном и осевом направлениях, разделенных 230 и 208 нм соответственно (рис.4 F – H ).
Рис. 4.Мультифокальное сверхразрешенное (MFM STORM) изображение митохондрий. Клетки HeLa, экспрессирующие TOM20 – GFP, метили конъюгатом Alexa 647 нанотела против GFP. ( A ) Изображение, записанное широкопольным MFM. (Шкала: 5 мкм.) ( B ) Изображение, записанное MFM STORM. Одиночные флуорофоры Alexa 647 обнаруживаются в разных фокальных плоскостях. (Масштаб: 5 мкм.) ( C ) Восстановленное трехмерное изображение со сверхвысоким разрешением (глубина кодируется цветом) (фильмы S3 – S5).Локализации представлены в виде изотропных трехмерных гауссовских профилей 20-нм SD с использованием программы трехмерной реконструкции со сверхвысоким разрешением ViSP (29). (Масштаб: 2 мкм.) ( D и E ) Увеличенный вид области 1 в C , показывающий вид сбоку и ось соответственно. (Масштаб: 500 нм.) ( F и G ) Профиль плотности обнаружения структуры 2 в C , нанесенный в поперечном и осевом направлениях соответственно. ( H ) Поперечное сечение структуры, показанной в F и G , показывающее просвет митохондрий (стрелка = 100 нм).
Визуализация дрожжей.
Во втором примере мы применили подход 3D MFM PALM / STORM к почкующимся клеткам дрожжей ( Saccharomyces cerevisiae ). Несмотря на их частое использование в качестве модельной системы в клеточной биологии, дрожжевые клетки редко визуализируются с помощью микроскопии сверхвысокого разрешения (26). В частности, их округлая форма и толстая клеточная стенка представляют собой серьезное препятствие для приложений PALM, что делает невозможным получение изображений в режиме полного внутреннего отражения. Глубина визуализации MFM почти соответствует размеру дрожжевых клеток ~ 5 мкм и, таким образом, идеально подходит для визуализации целых клеток со сверхвысоким разрешением.Мы генетически ввели фотоконвертируемую метку tdEos (тандемная димерная форма флуоресцентного белка Eos) на С-конце одного из генов α-тубулина в диплоидном штамме. Затем фиксированные PFA клетки покрывали конъюгатом конканавалин A-Alexa 647 для мечения клеточных стенок. Данные двухцветного сверхразрешения получали последовательно. Сначала Alexa 647 переводили [в присутствии 100 мМ гидрохлорида цистеамина (MEA)] в темное состояние с интенсивным освещением 640 нм. Во-вторых, отдельные молекулы Alexa 647 наблюдались во время их временного возврата в флуоресцентное состояние (режим STORM).После получения ~ 20000 кадров (когда флуоресцентные события Alexa 647 стали редкими), мы переключились на PALM-визуализацию tdEos-тубулина. Одиночные молекулы были активированы в флуорофоры, излучающие оранжевый цвет, путем низкоинтенсивного фотопреобразования с помощью лазерного света с длиной волны 405 нм, обнаружены и обесцвечены при интенсивном освещении 561 нм (2 кВт / см 2 ). Для анализа мы применили фильтрацию плотности соседства к данным tdEos, чтобы исключить свободный α-тубулин, который в большом количестве присутствует в цитоплазме и иммобилизован путем фиксации ( SI Text ).Этот подход позволил лучше визуализировать митотические веретена и микротрубочки (Movie S6). Были проанализированы клетки на разных стадиях клеточного цикла, и типичные примеры представлены на рис. 5. В случае клеток, переживающих телофазу, мы могли легко локализовать шпиндели, украшенные α-тубулином и tdEos, поскольку они проходят через узкую шейку, соединяющую материнская клетка и почка (рис. 5 C и D ). На этой стадии митоза веретено состоит примерно из двух-четырех микротрубочек.Дополнительные примеры дрожжевых клеток, отображаемых на разных стадиях клеточного цикла, показаны на рис. 5. Во всех наблюдаемых случаях можно было идентифицировать веретено или микротрубочку внутри клетки, заключенную в клеточную стенку. Наблюдаемые паттерны соответствуют известной ориентации веретена-микротрубочки (30) (обычные широкопольные изображения показаны для сравнения в Supporting Information и Fig. S11). Помимо митотического веретена, мы могли обнаружить цитоплазматические микротрубочки, простирающиеся от обоих концов веретена во всем осевом диапазоне (рис.5 С ). В этом конкретном примере измеренные профили волокон тубулина в нефильтрованных данных о локализации показали полумаксимальную ширину (FWHM) ~ 65 нм в латеральном направлении и ~ 108 нм в осевом направлении (рис. S12). Эти значения больше, чем заявленные значения 25 нм в исх. 26, но разница может быть связана с пониженной точностью локализации в наших измерениях и вкладом размера тега tdEos.
Рис. 5.Двухцветные изображения MFM PALM / STORM со сверхвысоким разрешением дрожжевых клеток, содержащих α-тубулин – tdEos- и Con A – Alexa 647-меченую клеточную стенку.Красно-желтая шкала кодирует z позиций обнаружения Alexa 647, а сине-белая шкала соответствует tdEos. ( Left ) Ячейки показаны в виде xy с глубиной цвета. (Масштаб: 1 мкм.) ( Центр ) Наклонный вид показывает митотическое веретено, проходящее через шейку почки во время деления. (Длина осей: 1 мкм.) ( Справа ) Поверхностный рендеринг локализаций tdEos в сине-белом цвете. Здесь цветовой код представляет собой плотность молекул.Снимки демонстрируют почкующиеся дрожжи на разных стадиях деления клеток. (Длина шкалы и оси: 1 мкм.) ( A ) Метафазная клетка с коротким внутриядерным веретеном, не ориентированным к шейке. ( B ) Клетка входит в анафазу, когда веретено начинает проникать через отверстие шеи. ( C ) Поздняя анафаза / телофазная клетка с митотическим веретеном, проходящим через шейку почки (Movie S6). ( D ) Клетка в конце телофазы с распадающимся веретеном, распадающимся между материнской и дочерней клетками.( E ) Постмитотические клетки G1 без веретена.
Заключение
В исследовании органелл клетки трехмерная микроскопия сверхвысокого разрешения становится важным инструментом. Наши результаты показывают, что мультифокусная микроскопия в сочетании с визуализацией PALM / STORM позволяет получать объемные изображения со сверхвысоким разрешением на глубине ∼4 мкм, что намного больше, чем другие методы, и обеспечивает точность локализации ∼20 и ∼50 нм в латеральном и осевом направлениях соответственно. Поскольку точность напрямую зависит от количества обнаруженных фотонов, в будущем она, вероятно, будет улучшена за счет использования более ярких флуорофоров и более эффективных конструкций решеток.В частности, использование многофазной решетки вместо бинарной может увеличить дифракционную эффективность до девяти центральных порядков примерно на ∼90% (31). Модифицированные конструкции с дифрагированным светом, сосредоточенным в 25 центральных порядках (вместо заявленных 9 порядков), также могут увеличить глубину изображения без ущерба для точности осевой выборки. В отличие от последовательного сканирования z для получения трехмерных изображений, наш подход позволяет получать изображения соответствующих расфокусированных молекул до того, как они станут фотообесцвеченными.Улавливание максимального количества одиночных молекул на клеточном уровне является важным преимуществом, особенно когда задействованы низкие числа копий флуоресцентных белков. Проблемой для 3D-микроскопии PALM / STORM является большое количество молекул, которые необходимо локализовать для правильной реконструкции изображения, что приводит к увеличению времени сбора данных и потенциально перекрывающимся PSF. Эти трудности можно облегчить с помощью вычислительных инструментов, таких как подгонка нескольких эмиттеров (32) или сжатое зондирование (33, 34), которые позволяют локализовать одиночные молекулы при более высоких плотностях.Таким образом, мы считаем, что многофокусная микроскопия открывает новые захватывающие возможности для получения изображений сверхвысокого разрешения целых клеток в биологических науках.
Методы
Настройка.
Для получения мультифокальных изображений на пути излучения обычного широкоугольного микроскопа (Nikon Ti-Eclipse) вводятся специальные оптические элементы (рис. 2) (23). Во-первых, дифракционная решетка, сопряженная с плоскостью заднего зрачка объектива (100 ×, 1,4 N.A .; Nikon), направляет падающий свет на девять центральных порядков с эффективностью ~ 65%.Рисунок решетки искажается, чтобы внести сдвиг фокусного расстояния между порядками дифракции. Во-вторых, комбинация светящейся решетки и призмы используется для коррекции остаточной хроматической дисперсии. В-третьих, линза формирования изображения формирует изображение девяти порядков (соответствующих девяти различным плоскостям изображения) на одном детекторе EM – CCD (DU-897; Andor). Освещение для возбуждения и активации обеспечивается набором лазеров (405, 488, 514, 560 и 640 нм), управляемых акустооптическим перестраиваемым фильтром (AA Opto-Electronic) и соединенных в одномодовое волокно.Выходной свет волокна повторно коллимируется и направляется на объектив микроскопа многополосным дихроичным зеркалом (LF405 / 488/561 / 635–4 × 4M-A-000; Semrock). Область возбуждения и активации ограничена по бокам щелью, размещенной на пути возбуждения, тогда как вторая щель на пути излучения используется для ограничения отображаемой области и предотвращения перекрытия девяти плоскостей на детекторе. Мы дополнительно разместили перед камерой полосовой фильтр (FF01-607 / 36 для PALM-визуализации tdEos и FF01-670 / 30 для STORM-визуализации Alexa 647; Semrock).
Из-за длительного времени записи (обычно ≥20 мин) для получения необработанных данных для восстановления трехмерного изображения со сверхвысоким разрешением необходимо скорректировать дрейф выборки. С этой целью шарики из полистирола (диаметром 4 мкм; Dynabeads) помещали на покровное стекло рядом с клетками-мишенями и наблюдали с помощью ИК-камеры в качестве фидуциарных маркеров (рис. 2, SI Text и рис. S5– S7). Анализ положения шариков и их дифрактограмм позволил точно определить латеральные и осевые сдвиги образца с SD менее 1 нм в латеральном направлении и 5 нм в осевом направлении.Эти координаты впоследствии были использованы для корректировки дрейфа трехмерного образца.
Калибровка системы и анализ данных.
Многоцветные флуоресцентные шарики (TetraSpeck Fluorescent Microspheres Kit; T14792; Invitrogen), иммобилизованные на покровном стекле, были использованы для калибровки установки 3D-визуализации и обеспечения точной реконструкции необработанных изображений в стопку z с минимальной потерей разрешения (23). При перемещении предметного столика микроскопа с пьезоэлементом на фиксированные шаги вдоль оптической оси, шарики последовательно появляются в фокусе на различных панелях (плоскостях z ) изображения.Проекция максимальной интенсивности полученного стека показывает, что шарики появляются в фокусе на девяти панелях. После определения центра гранул с помощью гауссовой аппроксимации вычисляется матрица преобразования для повторного выравнивания различных панелей с точностью порядка 2 нм (стандартное отклонение).
Кроме того, бинарная фазовая решетка, используемая в нашем MFM, дифрагирует около 65% падающего света в девяти (3 × 3) центральных порядках на расчетной длине волны. Относительные флуктуации между интенсивностями составляют порядка ~ 5% при проектной длине волны решетки (515 нм) и увеличиваются до ~ 50% при длине волны 670 нм, в основном из-за более яркого (0, 0) порядка.Поэтому для обеспечения правильной реконструкции объема изображения и достижения точной оценки осевого положения отдельных молекул применяется коррекция интенсивности после получения различных панелей.
Таким образом, необработанные изображения (пример показан в Movie S1) обрабатываются следующим образом. Сначала вычитается смещение камеры. Во-вторых, панели изображений разделяются и выравниваются с использованием матрицы преобразования, созданной на этапе калибровки шариков. В-третьих, корректируются относительные интенсивности различных панелей; Трехмерная гауссовская аппроксимация отдельных трехмерных PSF была выполнена с помощью свободно доступного программного обеспечения FishQUANT (35) для определения положения эмиттера, а трехмерные изображения со сверхвысоким разрешением визуализировались с помощью программного обеспечения ViSP (29).
Двухцветная колокализация и
z — Коррекция положения.Калибровка выполняется перемещением разноцветных флуоресцентных шариков, установленных на покровном стекле, вдоль оптической оси при последовательной записи изображений в двух спектральных каналах в каждой позиции. Проекционное изображение максимальной интенсивности каждого канала было реконструировано, и шарики были локализованы на разных панелях изображения в разных каналах.
Затем положение гранул на каждой панели изображений сравнивалось с центральной (неискаженной) панелью красного канала.Относительные положения служили основой для двух калибровочных матриц, которые позволяли точно реконструировать трехмерный объем, а также точно совмещать плоскости двух каналов с учетом любого возможного увеличения, поворота или трансформации.
Любое смещение номинальной плоскости между двумя каналами также определялось и учитывалось на этапе постобработки, а также расстояние между плоскостями как функция длины волны изображения ( SI Text и рис.S3).
Общая точность спектральной регистрации составляет 10 нм в поперечном измерении и 30 нм в осевом направлении. Точность была определена экспериментально, когда разноцветные бусины отображались последовательно в двух каналах (рис. S4).
Благодарности
Мы благодарим покойного Матса Густаффсона за оригинальный дизайн многофокусного микроскопа; Саре Абрахамссон за помощь в разработке и изготовлении микроскопа; Флориану Мюллеру за помощь с программным обеспечением для локализации; Глебу Штенгелю, Давиде Норманно и Игнасио Изеддину за полезные обсуждения; членам Консорциума по визуализации транскрипции (TIC) Медицинского института Говарда Хьюза Джанелия Фарм за их помощь и обсуждение; ДокторКарин Буш для плазмиды TOM20-GFP; Люку Лавису и Джонатану Б. Гримму за обмен красителями и полезные обсуждения; отдел информационных технологий (ИТ) исследовательского центра Janelia Farm Research Campus для настройки конвейера кластерного анализа и помощи с программным обеспечением; и Василию Гурченкову за его вклад в создание фигур и графического изображения. B.H. благодарит TIC, Фонд Пьера Жиля де Женна и Агентство по изучению рака (Фонд ARC) за финансовую поддержку. Мы благодарим за финансовую поддержку программы Paris-Science-Lettres Французского национального исследовательского агентства (ANR) (ANR-10- IDEX-0001-02 PSL), Labex CelTisPhyBio (N ° ANR-10-LBX-0038), поддерживаемой инфраструктуры France-BioImaging. от ANR Grant ANR-10-INSB-04 (Инвестиции в будущее) и ANR Grant TRIDIMIC.
Сноски
Вклад авторов: B.H., C.W. и M.D. разработали исследование; B.H., J.W. и J.C. провели исследования; B.H., M.E.B. и A.R. внесены новые реагенты / аналитические инструменты; B.H. проанализированные данные; B.H. и доктор медицины написал статью; B.H. спроектировал и смонтировал установку микроскопа и разработал трубопровод; и Дж. и C.W. предложили и сконструировали штамм дрожжей.
Авторы заявляют об отсутствии конфликта интересов.
↵ * Для этой статьи с прямым представлением был назначен редактор.
Эта статья содержит вспомогательную информацию на сайте www.pnas.org/lookup/suppl/doi:10.1073/pnas.1412396111/-/DCSupplemental.
Датчики шариков полиакриламида для количественной оценки стресса в масштабе клеток in vivo при развитии рыбок данио
, # 1, 2 , # 3 , 2, 4, 000 , 4 , 2 , 1 , 4, 5 , 4 , 4 , 1 , 3 и 2, 2, .Träber1 Leibniz-Institut für Polymerforschung Dresden e. В., Hohe Str. 6, 01069 Дрезден, Германия
2 Биотехнологический центр, Центр молекулярной и клеточной биоинженерии, Технический университет Дрездена, Тацберг 47/49, 01307 Дрезден, Германия
К. Ульманн
3 Рур, кафедра механики сплошных сред -Universität Bochum, Universitätsstraße 150, 44801 Bochum, Germany
S. Girardo
2 Центр биотехнологии, Центр молекулярной и клеточной биоинженерии, Technische Universität Dresden, Tatzberg 47/49, 01307 40004, Dresden, Германия регенеративной терапии, Дрезден, Центр молекулярной и клеточной биоинженерии, Технический университет Дрездена, Fetscherstr.105, 01307 Дрезден, Германия
5 Институт науки света Макса Планка, Staudtstraße 2,
Эрланген, ГерманияG. Kesavan
4 Центр регенеративной терапии Дрезден, Центр молекулярной и клеточной биоинженерии Технический университет Дрездена, Fetscherstr. 105, 01307 Дрезден, Германия
K. Wagner
2 Биотехнологический центр, Центр молекулярной и клеточной биоинженерии, Технический университет Дрездена, Тацберг 47/49, 01307 Дрезден, Германия
J.Friedrichs
1 Leibniz-Institut für Polymerforschung Dresden e. В., Hohe Str. 6, 01069 Дрезден, Германия
R. Goswami
4 Центр регенеративной терапии в Дрездене, Центр молекулярной и клеточной биоинженерии, Технический университет Дрездена, Fetscherstr. 105, 01307 Дрезден, Германия
5 Институт науки о свете Макса Планка, Штаудтштрассе 2, Эрланген, Германия
К. Бай
4 Центр регенеративной терапии Дрезден, Центр молекулярной и клеточной биоинженерии, Технический университет Дрездена, Fetscherstr.105, 01307 Дрезден, Германия
M. Brand
4 Центр регенеративной терапии Дрезден, Центр молекулярной и клеточной биоинженерии, Технический университет Дрездена, Fetscherstr. 105, 01307 Дрезден, Германия
К. Вернер
1 Leibniz-Institut für Polymerforschung Dresden e. В., Hohe Str. 6, 01069 Дрезден, Германия
D. Balzani
3 Кафедра механики сплошной среды, Рурский университет Бохума, Universitätsstraße 150, 44801 Бохум, Германия
J.Guck
2 Биотехнологический центр, Центр молекулярной и клеточной биоинженерии, Технический университет Дрездена, Тацберг 47/49, 01307 Дрезден, Германия
5 Институт науки о свете Макса Планка, Штаудтштрассе 2, Эрланген
1 Leibniz-Institut für Polymerforschung Dresden e. В., Hohe Str. 6, 01069 Дрезден, Германия
2 Центр биотехнологии, Центр молекулярной и клеточной биоинженерии, Технический университет Дрездена, Тацберг 47/49, 01307 Дрезден, Германия
3 Кафедра механики сплошных сред, Рурский университет 150, 44801 Бохум, Германия
4 Центр регенеративной терапии в Дрездене, Центр молекулярной и клеточной биоинженерии, Технический университет Дрездена, Fetscherstr.105, 01307 Дрезден, Германия
5 Институт науки о свете Макса Планка, Staudtstraße 2, Эрланген, Германия
Автор, отвечающий за переписку.# Распространяется поровну.
Поступила 19.06.2019; Принято 23 октября 2019 г.
Открытый доступ Эта статья находится под международной лицензией Creative Commons Attribution 4.0, которая разрешает использование, совместное использование, адаптацию, распространение и воспроизведение на любом носителе или любом формате при условии, что вы укажете надлежащую ссылку на оригинал. Автор (ы) и источник предоставляют ссылку на лицензию Creative Commons и указывают, были ли внесены изменения.Изображения или другие сторонние материалы в этой статье включены в лицензию Creative Commons, если иное не указано в кредитной линии для материала. Если материал не включен в лицензию Creative Commons для статьи и ваше предполагаемое использование не разрешено законодательными актами или превышает разрешенное использование, вам необходимо получить разрешение непосредственно от правообладателя. Чтобы просмотреть копию этой лицензии, посетите http://creativecommons.org/licenses/by/4.0/. Эта статья цитируется в других статьях PMC.Abstract
Механический стресс, проявляемый и испытываемый клетками во время морфогенеза тканей и формирования органов, играет важную роль в эмбриональном развитии. В то время как методы количественной оценки механических напряжений in vitro доступны, существует несколько методов для изучения стрессов в живых организмах. Здесь мы описываем и охарактеризуем сенсоры шариков из полиакриламида (PAAm), подобные клеткам, с четко определенными эластичными свойствами и размером для in vivo количественной оценки стрессов на уровне клеток.Бусинки вводили в развивающиеся эмбрионы рыбок данио, и их деформации анализировали с помощью вычислений, чтобы определить пространственно-временные локальные действующие напряжения. С помощью этого компьютерного анализа, основанного на измерении стресса на уровне клетки (COMPAX), мы можем обнаруживать пульсирующее распространение давления в развивающемся нервном стержне, которое потенциально может происходить из поляризованных делений клеток средней линии и непрерывного тканевого потока. Ожидается, что COMPAX предоставит новое пространственно-временное представление о процессах развития на локальном тканевом уровне и будет способствовать количественному исследованию и лучшему пониманию морфогенетических процессов.
Тематические термины: Датчики и зонды, Вычислительная биофизика, Инженерия
Введение
Механическая передача сигналов была признана одним из ключевых факторов, регулирующих клеточное поведение 1 — 3 и, таким образом, управляющих эмбриональным развитием, морфогенезом и формирование рисунка ткани 4 — 11 . Важной предпосылкой для дальнейшего прогресса является наличие соответствующих методов, которые могут либо количественно оценить стрессы, действующие на клетки или оказываемые ими, либо применить известные стрессы к клеткам для изучения их биологической реакции.Для этой цели уже существует множество методов измерения. Атомно-силовая микроскопия 12 , 13 и микропипеточная аспирация 14 используются в качестве стандартных методов для количественной оценки механических свойств путем прямого приложения контролируемых сил к клеткам или образцам тканей. Напротив, микроскопия силы тяги 15 и микростолбы 16 , 17 используют деформацию окружающего материала для определения создаваемых клетками сил растяжения.Тем не менее, важно подчеркнуть, что эти методы позволяют только in vitro исследовать взаимодействие между механическими сигналами или свойствами материала и результирующим клеточным поведением. Обнаружение сил in vivo остается сложной задачей и требует разработки соответствующих инструментов 18 — 20 .
Датчики флуоресцентного резонансного переноса энергии (FRET) все чаще используются в молекулярном масштабе для обнаружения и количественной оценки сил, действующих внутри живых организмов 21 , 22 .Хотя это ценный инструмент для измерения сил, действующих на отдельные молекулы, он не может предоставить информацию о напряжениях в клеточном масштабе. С введением биосовместимых микрокапель масла в качестве преобразователей силы на клеточном уровне Campas et al . (2014) разработали новаторский метод количественной оценки сил, генерируемых клетками в живых тканях 23 . На основе вызванных клетками деформаций микрокапель, которые были микроинъектированы во внеклеточное пространство клеточных агрегатов и тканевых эксплантатов, можно было количественно оценить анизотропные нормальные стрессы.Этот метод теперь усовершенствован до такой степени, что было показано, что переход от жидкости к твердому телу лежит в основе удлинения оси тела позвоночного у эмбрионов рыбок данио 24 . Однако из-за несжимаемости микрокапель масла оценка изотропного тканевого давления (отрицательное гидростатическое напряжение) была невозможна.
Недавно концепция использования калиброванных сферических зондов в качестве датчиков силы была усовершенствована путем введения микрогранул из эластичного полиакриламида (PAAm) для количественной оценки сжимающего напряжения в многоклеточных сфероидах 25 .В отличие от масляных микрокапель, гидрогелевые зонды сжимаются и, следовательно, позволяют количественно определять локальные изменения давления, отслеживая изменение объема шарика. Однако, поскольку модули сдвига или упругости этих шариков из ПААм оставались неопределенными, их применение было ограничено идентификацией изотропных напряжений. Совсем недавно Ли и др. ., 2019 подтвердили применимость шариков из ПААм для определения механического напряжения в многоклеточных сфероидах 26 .В отличие от шариков из ПААм, представленных Dolega и др. ., Можно было оценить деформации эллипсоидальной формы. Однако производство монодисперсных шариков было невозможным, что исключало надежное применение in vivo этих шариковых датчиков.
В другом исследовании эластичные круглые микрогели (ERMG) из альгината, наполненные флуоресцентными наночастицами, использовались для количественной оценки изотропных и анизотропных сжимающих напряжений в живых тканях путем отслеживания смещения наночастиц 27 .Это представляет собой многообещающий метод выявления стрессов, как in vitro , так и in vivo . Количественный анализ деформаций микросфер основан на определении сферической формы без напряжений в качестве эталонной конфигурации. Таким образом, точность этого общего подхода в решающей степени зависит от наличия сжимаемых, упругих сфер, форма, размер и механические свойства которых хорошо установлены до впрыска.
Здесь мы представляем метод, который позволяет обойти ограничения существующих датчиков напряжения в клеточном масштабе.Мы проверяем PAAm как подходящий материал для создания сферических шариков, похожих на клетки, с узким распределением размеров с использованием капельной микрофлюидики. Мы подробно охарактеризовали как сжимаемость, так и модуль упругости шариков, чтобы дать возможность количественной оценки изотропных и анизотропных напряжений. Это подробное определение размера и механических свойств перед инъекцией обеспечивает методическую основу для in vivo использования компьютерного анализа, основанного на измерении напряжения на уровне клеток (COMPAX).Важно отметить, что это устраняет необходимость восстанавливать шарики, наблюдаемые после эксперимента, чтобы получить сведения об их индивидуальной эталонной конфигурации без напряжений. Мы демонстрируем полезность COMPAX с использованием шариков PAAm путем пространственной и временной количественной оценки впервые стрессов, действующих в развивающемся нервном стержне рыбок данио. Мы показываем наличие колебательного распространения давления, которое потенциально может быть вызвано поляризованными делениями клеток, и количественно оцениваем распределение сжимающего напряжения в ткани во время развития нервного стержня.COMPAX не только предоставит новое пространственно-временное представление о морфогенетических процессах у эмбрионов, но также может быть использован для количественной оценки стрессов во взрослых тканях и органоидах или когда гранулы сталкиваются с отдельными клетками во время фагоцитоза или миграции.
Результаты
Изготовление и механические характеристики шариков из ПААм
Производство стандартизированных клеточноподобных эластичных шариков из ПААм недавно было описано нашей группой в другом месте 28 . Чтобы использовать эти шарики в качестве датчиков силы, мы отрегулировали их размер и эластичные свойства, чтобы они были почти однородными и подобными свойствам ячеек.Сферические шарики PAAm получали путем контролируемой полимеризации акриламида и N, N´-метиленбисакриламида в микрофлюидном устройстве с фокусировкой потока (левая вставка на рис.) Для получения частиц однородного размера с диаметром 17,0 мкм ± 0,5 мкм (среднее значение ± стандартное отклонение, рис. .). Изменяя общие концентрации мономеров, модуль упругости гранул был скорректирован для имитации типичного диапазона жесткости эукариотических клеток 29 (при условии, что клетки могут быть представлены как гомогенный изотропный эластичный материал в самом низком порядке).Чтобы сделать инертные шарики PAAm биоадгезивными и обеспечить визуализацию реакции на стресс в реальном времени, их после получения ковалентно модифицировали поли-L-лизином (PLL), конъюгированным с флуорофором Cy3 (PLL-Cy3) через NHS-эфир. (правая вставка рис.) 28 .
Механические характеристики шариков из полиакриламида (PAAm). ( a) Распределение размеров функционализированных Cy3-конъюгированным поли-L-лизином (PLL-Cy3) шариков PAAm ( n = 1339), определенное макросом, реализованным на Фиджи 28 .На вставке слева: микроскопическое изображение образования шариков с помощью фокусировки микрожидкостным потоком. Вставка справа: срез конфокальной микроскопии, показывающий гранулы PAAm (пурпурный), функционализированные PLL-Cy3. Масштабная линейка 15 мкм. (b) Модуль Юнга шариков PAAm, определенный методом вдавливания на основе AFM после полимеризации PAAm (без NHS), после модификации сложным эфиром NHS (w NHS) и после функционализации PLL-Cy3 ( n = 50, температура = 24 ° С). (c) Стабильность модуля Юнга при повышении температуры.Идентичные гранулы PAAm, функционализированные PLL-Cy3 ( n = 25), измеряли для каждого условия. (d) Отношение напряжения к деформации гранул PAAm, функционализированных PLL-Cy3, во время осмотического сжатия. Пунктирная линия указывает на линейную аппроксимацию, которая используется для определения модуля объемной упругости. Результаты представлены как среднее ± стандартное отклонение. Вставка: изображения конфокальной микроскопии шарика PAAm (пурпурный) в растворе декстрана (этикетка FITC, зеленый), подтверждающие, что молекулы декстрана (гидродинамический радиус: 27 нм) не могут проникать в полимерную сеть (размер ячейки: 21 нм 28 ).Масштабная линейка, 20 мкм. (b, c) Блоки определяются 25 процентилями -го и 75 -го . Среднее значение показано закрашенным квадратным символом, медиана — прямой линией, усы представляют собой стандартное отклонение, а процентили 1 и 99 обозначены крестиками. (b – d) Вставки — схематическое изображение применяемых методов. Однородное осмотическое давление, сжимающее валик, и сферический наконечник кантилевера, вдавливающий валик из PAAm, соответственно.
Наноиндентирование коллоидных зондов на основе атомно-силовой микроскопии (АСМ) применялось для определения модуля упругости шариков из ПААм в начальном (небольшом) режиме деформации и для анализа влияния различных этапов обработки и параметров окружающей среды на жесткость шариков. На рисунке показано влияние функционализации PLL-Cy3 на модуль упругости шариков из PAAm. Гранулы из немодифицированного PAAm показали модуль Юнга 1,4 ± 0,6 кПа (среднее ± стандартное отклонение). Гранулы PAAm, которые были модифицированы NHS-эфиром, существенно не увеличивали эластичность гранул (1.6 ± 0,6 кПа). Добавление PLL-Cy3 к гранулам, модифицированным NHS, несколько повысило эластичность гранул до 1,8 ± 0,7 кПа. Это значение затем использовали для дальнейшего анализа деформации шарика in vivo . Нечувствительность механических свойств гранул к разным физиологическим температурам была подтверждена измерениями с помощью АСМ одних и тех же гранул PAAm при температурах 24–50 ° C (рис.). При всех испытанных условиях модуль упругости валиков оставался постоянным. Модули Юнга, определенные с помощью АСМ, были подтверждены численной реконструкцией процесса вдавливания и показали, что реконструированное радиальное смещение соответствует увеличению диаметра шарика, полученному с помощью конфокальной микроскопии во время вдавливания коллоидного зонда (дополнительный рис. 1 ).
Измерение изменения объема гранул PLL-Cy3 PAAm в зависимости от осмотического давления с использованием растворов декстрана. 25 , 30 использовали для определения модуля объемной упругости (рис.). Линейная аппроксимация кривой при малых деформациях в области упругой деформации дала объемный модуль упругости = 6,2 ± 0,2 кПа (среднее ± стандартное отклонение). Учитывая коэффициент Пуассона ν , который ранее был определен как 0,443 28 , корреляция между модулем объемного сжатия ĸ и модулем упругости E может быть описана с помощью уравнения E = 3 ( 1 –2ν ), что соответствует модулю Юнга 2.1 ± 0,3 кПа. Это независимо подтвердило значение, полученное методом АСМ индентирования.
Кроме того, прессование пластин объемных гелей PAAm также подтвердило эластичность гранул при малых сжатиях (дополнительный рисунок 2 ). Одновременно эти измерения показали нелинейное поведение материала PAAm при больших деформациях, что не позволило применить каркас с малой деформацией (геометрически линейный). Однако для умеренных деформаций до 15% реакция материала была лишь слегка нелинейной, что указывало на возможность использования довольно простой формулировки конечной деформации (например,грамм. Модель Неогука) для анализа деформаций валика.
Сжимаемость гранул PAAm дополнительно подтверждали включением гранул в агрегаты мезенхимальных стромальных клеток (MSC) человека (дополнительная фигура 3 ). Через 24 и 48 часов культивирования гранулы PAAm, функционализированные PLL-Cy3, показали значительное уменьшение объема. После диссоциации клеток после 14 дней культивирования объем шариков вернулся к своему исходному значению (восстановление формы), что свидетельствует о свойствах их эластичного материала даже в течение продолжительных периодов времени.Вместе эти подробные характеристики материала гранул из ПААм, сжимаемости и модуля упругости обеспечивают основу для последующего вычислительного анализа in vivo деформаций гранул.
Определение напряжения на уровне клетки на основе компьютерного анализа
В текущем исследовании деформации бусинок, вызванные клетками, анализируются и преобразуются в напряжения с использованием недавно разработанного метода, называемого датчиком напряжения на уровне клеток на основе компьютерного анализа (COMPAX). COMPAX состоит из трех основных этапов.На первом этапе (рис.) Мы зарегистрировали двумерные конфокальные изображения деформированных шариков PAAm, внедренных в ткань эмбриона рыбок данио. Поскольку мы стремились запечатлеть детальную форму шариков, избегая при этом как можно большего шума на конфокальных изображениях, расстояние между отдельными двумерными сечениями было выбрано равным 1 мкм. На основе этого мы построили трехмерную геометрию деформированного валика PAAm и подходящую дискретизацию методом конечных элементов (КЭ) с использованием программного обеспечения для трехмерной визуализации и обработки Avizo.Первый шаг в создании геометрии с использованием конфокальных изображений включает сегментацию вокселей, принадлежащих микрошарикам. Затем геометрия бусинки интерполируется между конфокальными изображениями в соответствии с определенными критериями. Поскольку процесс создания геометрии является фиксированным порядком, качество результатов COMPAX остается неизменным.
Рабочий процесс для вычислительного анализа напряжений в масштабе ячейки. ( a) Деформированная форма шарика PAAm фиксируется конфокальной микроскопией.( b ) Построена трехмерная КЭ дискретизация недеформированной конфигурации. Для этого вычисляются радиальные векторы расстояний (светло-серые стрелки), указывающие на поверхность недеформированной конфигурации, которая считается сферой. (c) Обратные векторы радиальных расстояний (красные стрелки) применяются в качестве векторов смещения поверхности в анализе КЭ для вычисления напряжений деформированного валика.
На втором этапе (рис.) Были оценены недеформированная конфигурация и приблизительные граничные условия.Поскольку каждый деформированный валик (пока) не может быть отнесен к его недеформированной конфигурации по техническим причинам, недеформированное состояние обычно неизвестно. Однако воодушевленные почти однородным производством шариков из ПААм, приводящим к узкому распределению по форме и диаметру, мы рассмотрели эталонную геометрию шариков как сферу со средним диаметром 17,0 мкм. Чтобы построить сетку КЭ для соответствующей эталонной конфигурации, мы вычислили радиальные векторы расстояний, указывающие от поверхностных узлов деформированной сетки к предполагаемой сферической эталонной геометрии, и использовали эти векторы расстояний в качестве граничных условий Дирихле во время предварительной обработки анализа КЭ.Полученная деформированная конфигурация затем использовалась в качестве сетки для предполагаемой недеформированной геометрии валика. На этом этапе приближение среднего давления уже возможно путем вычисления изменения объема валика на основе созданных сеток (см. Раздел «Численное моделирование»). Однако, поскольку это приближение включает упрощения теории малых деформаций, точность ограничена.
На третьем шаге (рис.) Мы применили обратные векторы радиальных расстояний как поверхностные смещения к сетке, построенной на шаге 2.Затем было выполнено основное моделирование КЭ, чтобы получить распределение напряжений, которое, как предполагалось, имитировало распределение напряжения в реальном валике из ПАА. Для этого моделирования мы рассмотрели модель материала Нео-Гука в геометрически нелинейной механике сплошной среды, которая учитывала большие смещения (см. Также дополнительный рис. 2 ). Два параметра материала E и ν были оценены из линеаризованной ситуации, полученной ранее, то есть они совпадали с модулем Юнга и коэффициентом Пуассона из структуры линейной упругости, которая описывает начальную реакцию напряжения-деформации при малых деформациях.Учитывая большие деформации, модель показала незначительный нелинейный рост напряжений с увеличением деформаций. Это было мотивировано тем фактом, что в валике произошли большие смещения; однако результирующая реакция напряжение-деформация была лишь слегка нелинейной в режиме больших деформаций примерно до 10% (дополнительный рисунок 2 ). Обратите внимание, что деформации в анализируемых шариках были в основном этого уровня, в то время как локальные максимальные значения достигли примерно 20%.
Цифровая проверка
COMPAX представляет собой новый подход к количественной оценке клеточных напряжений внутри мягких тканей, который позволяет определять изотропные напряжения, а также отчетливые изменения формы гранул.Таким образом, численная проверка имела большое значение для оценки точности расчетного напряженного состояния с качественной и количественной точки зрения. С этой целью мы проанализировали несколько искусственно созданных сценариев нагрузки, применяемых к сферическому валику диаметром 17,0 мкм, модулем Юнга 1,8 кПа и коэффициентом Пуассона 0,443. Эти искусственно деформированные бусины служили виртуальными экспериментами, в которых сравнивались напряжения, полученные с помощью COMPAX путем анализа форм, полученных в результате эталонного моделирования, с известными данными, использованными для моделирования (рис.). Обратите внимание, что для COMPAX использовались те же параметры диаметра и материала, что и для эталонного моделирования, так что различия в результатах должны быть порядка компьютерной точности в идеальном сценарии.
Валидация метода с использованием анализа численно деформированных шариков. Трехмерные контурные графики давления и главных напряжений в эталонном моделировании (слева) и результаты метода COMPAX (в центре). Контрольные значения, основанные на объемном среднем тензоре напряжений Коши (справа). (a) Применение периодического поверхностного давления дает почти одинаковые результаты для обоих расчетов. (б) Большие нерадиальные смещения приводят к локальным отклонениям на контурном графике. (c) Напряжения показывают обратные локальные значения для численного моделирования поверхностного сдвига, но почти нет разницы в среднем давлении.
Качество нашего подхода оценивалось по четырем критериям: локальные различия в поверхностном давлении σPres, величина и направление среднего объемного значения главных напряжений σ1Ø, σ2Ø и σ3Ø и среднее объемное давление σPresØ.Здесь под давлением понимается отрицательное гидростатическое напряжение, определяемое как среднее арифметическое нормальных напряжений. Положительные значения давления указывают на сжимающие изотропные напряжения (дополнительную информацию об определениях см. В разделе «Численное моделирование»). Обратите внимание, что под «нормальными» напряжениями, в отличие от касательных напряжений, мы понимаем те компоненты тензора напряжений, которые связаны с нормальными направлениями конкретных поперечных сечений в теле. В качестве проверки правдоподобия мы сначала сравнили результаты для однородного поверхностного давления 1000 Па, где результирующие смещения действительно радиальные.Результирующие напряжения COMPAX отличались от виртуальных данных значениями в порядке компьютерной точности, что означало, что метод был реализован правильно.
В первом подходящем сценарии испытаний мы определили периодическое поверхностное давление, интенсивность которого изменялась синусоидально с углом φ в координатах круга в плоскости x-y от минимума 600 Па до максимума 1000 Па с длиной волны π4. В этом случае сравнение показало отличное согласие виртуальных данных с методом COMPAX (рис.). В частности, практически идентичные изолинии показывают, что обнаружение больших колебаний приземного давления не представляет сложности для метода COMPAX.
Второй сценарий испытаний рассматривал квадратичное распределение поверхностного давления вдоль одной оси вращения борта с максимальным давлением 1000 Па на экваторе и минимальным давлением 600 Па на полюсах. На контурных графиках наблюдались некоторые локальные количественные различия, при этом также варьировались значения объемных средних главных напряжений (рис.). Тем не менее направление главных напряжений, а также среднее давление показали хорошее соответствие. В конечном сценарии нагрузки мы объединили однородное поверхностное давление 800 Па с двумя различными поперечными нагрузками 120 Па. Каждая из двух нагрузок была приложена тангенциально к одной из двух половин борта. Первая и вторая нагрузки были ориентированы с севера на южный полюс и с востока на западный полюс соответственно. Сравнивая контурный график на рис. 2, можно было наблюдать значительные количественные и качественные различия в локальных распределениях давления, даже несмотря на то, что направления главных напряжений и среднеобъемное значение давления оставались сопоставимыми.Кроме того, на дополнительном рисунке 5 показаны изолинии касательных напряжений для сценария окончательной нагрузки. Как и ожидалось, напряжения сдвига, создаваемые методом COMPAX, отличаются от напряжений сдвига в эталонном моделировании. Это связано с нашим предположением о радиальных смещениях на поверхности валика, которые приводят только к умеренным деформациям сдвига.
Эти искусственные ситуации еще не включали потенциальные ошибки, возникающие из-за неопределенностей измерения, например, связанных с формой недеформированного валика и параметрами материала.Поэтому был проведен анализ неопределенности для диаметра и модуля Юнга, который показал влияние до 30% стандартного отклонения среднего объемного давления в результате измеренных различий в этих двух параметрах (дополнительный рисунок 4 ).
В совокупности COMPAX был менее надежен при извлечении поверхностного сдвига и больших нерадиальных деформаций, что приводило к локальным отклонениям в вычислении напряжений и одновременно влияло на значения главных напряжений.Однако мы получили очень удовлетворительные результаты для определения среднего давления и направлений основных напряжений, которые, таким образом, в первую очередь анализировались в экспериментах.
Количественная оценка стрессов на уровне клеток во время развития рыбок данио
Силы, генерируемые клетками, которые возникают во время формирования нервных стержней у эмбрионов рыбок данио, были количественно определены путем компьютерной реконструкции деформаций встроенных шариков PLL-Cy3 PAAm. Гранулы были микроинъектированы в развивающуюся нервную пластинку на стадии хвостовой почки (10 часов после оплодотворения (hpf)), и использовалась покадровая конфокальная микроскопия для визуализации трехмерных изменений формы гранул в нейроэпителии (рис.).
Микроинъекция шариков PAAm в эмбрионы рыбок данио. ( a) Схематическое изображение процедуры микроинъекции и визуализации. Эмбрион иммобилизовали в агарозной форме, чтобы облегчить ориентацию анимального полюса вверх для микроинъекции. Гранулы PLL-Cy3 PAAm вводили на стадии зародыша развития рыбок данио (10 часов после оплодотворения). Для конфокальной визуализации деформаций шариков, вызванных действием клеток, эмбрион помещали в 1% агарозу с низкой температурой плавления. (b) Бусинка PAAm застряла между левой и правой стороной равномерно открытого нервного стержня (nr) в области границы среднего мозга и заднего мозга (mhb) эмбриона рыбок данио на стадии prim-15 (30 hpf).Распознаются развивающиеся глаза (е) и структуры центральной нервной системы. Anterior (A) — на изображении отмечено заднее (P) направление. Масштабная линейка 200 мкм; гранулы PLL-Cy3 PAAm окрашены в пурпурный цвет, а клеточные мембраны помечены GFP (зеленым).
Во-первых, мы проанализировали индуцированные клетками деформации бусинки, внедренной в развивающийся нервный стержень эмбриона рыбок данио. Бусинки и эмбрион были визуализированы в течение разных периодов времени через 14 часов после оплодотворения, 15 часов после оплодотворения и 20 часов после оплодотворения (рис.). На протяжении всего периода визуализации бусина оставалась постоянно позиционированной в базальной области нервного стержня, прилегающей к развивающимся отическим плакодам эмбриона.В указанные моменты времени COMPAX показал, что окружающие клетки воздействуют на бусинку силы, вызывающей ее деформацию (см. Деформированные формы на рис.). Здесь мы хотели различать локальные напряжения на отдельных участках валика и среднее объемное давление в целом.
In vivo количественная оценка клеточных стрессов во время формирования нервных стержней рыбок данио. ( a) Конфокальные срезы развивающегося нервного стержня (nr) эмбриона рыбок данио после инъекции шариков через 14 часов после оплодотворения, 15 часов после оплодотворения и 20 часов после оплодотворения.Бусинка PLL-Cy3 PAAm (пурпурная метка; белое поле) внедряется между нейральными клетками-предшественниками в базальной части нервного стержня, рефреймингом формирующимися отическими плакодами (oc). На изображении всегда отмечается переднее (A) и заднее (P) направление. Плазматическая мембрана всех клеток эмбриона рыбок данио отмечена зеленым. Масштабная линейка, 50 мкм. (b) Типичный контурный график давления, распределенного на поверхности шарика PAAm в начале периода визуализации при 14 hpf, 15 hpf и 20 hpf.Золотые стрелки указывают направления основных напряжений. Серые срезы представляют положения конфокальных плоскостей, изображенных на (c). ( c ) Наложение поперечного сечения контурного графика (представленного в b) и соответствующей конфокальной плоскости z-стека при 14 hpf, 15 hpf и 20 hpf. Угол φ представляет ориентацию нормального напряжения, изображенного на (d). Масштабная линейка, 20 мкм. (d) Трехмерное представление распределения нормальных напряжений для всего периода визуализации при 14 hpf, 15 hpf и 20 hpf.Обратите внимание, что здесь показаны усиленные значения, которые были нормализованы на абсолютные максимальные значения (см. Описания в тексте). Максимальные амплитуды нормальных напряжений отображаются красными точками. На этом и всех последующих рисунках периоды времени между измерениями обозначены серыми областями. Интервал отбора проб: 2 мин при 14 hpf, 5 мин при 15 и 20 hpf.
В то время как локальные растягивающие изотропные напряжения (значения отрицательного давления) были первоначально обнаружены при 14 hpf, объемное сжатие (значения положительного давления) преобладало в более поздние моменты времени.Временная эволюция среднего объемного давления для каждого периода времени, а также соответствующий объем шарика PAAm показаны на дополнительном рисунке 6a . Кроме того, рендеринг локального давления на основе COMPAX может быть связан с активностью соседних клеток, где распространение / деление клеток вызывает большее локальное сжатие. Примерное представление таких распределений давления можно найти на фиг. 4, на которой контурные графики распределенного давления в выбранных поперечных сечениях борта изображены в соответствующих конфокальных изображениях z-стопки.Чтобы количественно оценить преобладающие направления напряжения во время формирования нервного стержня, мы вычислили нормальные компоненты напряжения (действующие в плоскости x-y) как функцию направления в пространстве, описываемого углом φ (рис.). Для лучшей визуализации мы усилили извилистость полученных кривых напряжений, увеличив колебания вокруг среднего значения. Это было достигнуто путем первого расчета средних значений нормальных напряжений, действующих в плоскости x-y, и, во-вторых, масштабирования разностей нормальных напряжений до среднего в пять раз.Это позволило нам определить направления основных нормальных напряжений в плоскости x-y для последовательных моментов времени (см. Красные метки на рис.). Кроме того, нас интересовало развитие этих нормальных напряжений с течением времени. Хотя среднее значение в каждый момент времени не изменялось усилением, разная интенсивность колебаний приводила к абсолютным значениям нормальных напряжений, которые не сопоставимы для разных моментов времени. Поэтому нормальные напряжения мы нормировали на максимальное абсолютное значение нормального напряжения.
Мы наблюдали непрерывную пульсирующую картину распространения давления в базальной части нервного стержня в течение оцениваемых периодов. Интенсивность колебаний давления со временем уменьшалась, но они были четко заметны в течение всего периода оценки. Уменьшение изменений между распределениями напряжений в последовательных временных точках подразумевает преобладание глобального стрессового состояния над изменениями напряжения, вызванными локальными событиями. Кроме того, деформация валиков указала на изменение ориентации напряжения в течение первого периода визуализации при 14 hpf, о чем свидетельствует изменение направления максимального значения нормального напряжения.Ориентация на стресс оставалась неизменной в последующие периоды.
Это возникновение периодических колебаний давления во время развития рыбок данио было подтверждено микроинъекцией дополнительных шариков в нервную пластинку и отслеживанием их деформаций на идентичных стадиях развития (биологические повторения). Бусинка PAAm в положении, сравнимом с бусиной, показанной на рис. — в развивающейся структуре отической плакоды (базально локализованной) — также испытывала колебательные нормальные напряжения при 14 hpf и 15 hpf (рис., Дополнительный рисунок 6b ). Напротив, бусинка, расположенная близко к средней линии (апикально локализованной) нервного стержня внутри одного и того же эмбриона (рис., Дополнительный рис. 6c ), одновременно подвергалась импульсным растягивающим напряжениям. Картины деформации другой бусинки, внедренной рядом со средней линией в другом эмбрионе (рис., Дополнительный рис. 6d ), также подтвердили общую тенденцию распространения колебательного напряжения, но показали сжимающие напряжения только на 14 hpf, что можно объяснить непрерывным движением. этой бусинки от средней линии к базальной границе нервного стержня (вставка рис..
Пространственные и временные вариации нормального напряжения в нервном стержне рыбок данио во время развития. ( a) Левая панель: конфокальный срез шарика PLL-Cy3 PAAm (белый прямоугольник) внутри нервного стержня, заключенного между клетками отической плакоды (oc) на стадии 10 сомитов (14 hpf) и 12 сомитов. ступень (15 л.с.). Правая панель: трехмерное представление нормального распределения напряжений для всего периода съемки при 14 и 15 часах питания соответственно. Интервал отбора проб: 2 мин при 14 hpf, 5 мин при 15 hpf. (b) Левая панель: конфокальный срез шарика PLL-Cy3 PAAm (белый прямоугольник), внедренный (в тот же эмбрион, как показано на панели a) близко к средней линии (ml) нервного стержня (nr) на уровне 10 -сомитовая стадия и 12-сомитовая стадия. Правая панель: трехмерное представление нормального распределения напряжения за весь период визуализации при 14 и 15 часах питания соответственно. Интервал отбора проб: 2 мин при 14 hpf, 5 мин при 15 hpf. Обратите внимание, что положительные значения нормального напряжения соответствуют напряжениям растяжения. (c) Левая панель: конфокальный срез шарика PLL-Cy3 PAAm (белый прямоугольник) рядом со средней линией (мл) нервного стержня через 14 часов после оплодотворения.Вставка: Идентичная гранула после движения к базальной части нервного стержня в конце периода визуализации при 14,5 hpf. Правая панель: 3D-представление нормального распределения напряжений для всего периода съемки. Интервал выборки: 3 мин. (d) Левая панель: конфокальная секция шарика PLL-Cy3 PAAm, захваченного в развивающемся среднем мозге-заднем мозге (mbh) нервного стержня через 19 часов после оплодотворения. Пунктирными линиями обозначена граница mbh. Правая панель: 3D-представление нормального распределения напряжений для всего периода съемки.Интервал выборки: 2 мин. (a — d) Конфокальные изображения: переднее (A) и заднее (P) направления всегда отмечены на изображении. Гранулы PLL-Cy3 PAAm (пурпурная метка) и клеточные мембраны (помечены GFP; зеленые). Масштабная линейка 30 мкм. Обратите внимание, что на изображениях справа показаны усиленные значения, которые были нормализованы на абсолютные максимальные значения (см. Описания в тексте).
Чтобы визуализировать преобладающие силы после открытия желудочков в нервном стержне, были визуализированы деформации бусинки, расположенной в желудочке через 19 часов после оплодотворения (рис., Дополнительный рисунок 6e ). Бусина была окружена ячейками с двух сторон, но не прикреплена с двух других сторон. Анализ COMPAX выявил колеблющиеся сжимающие напряжения в развивающемся мозговом стержне. В целом, эти результаты указывают на наличие пространственно изменяющихся осцилляторных напряжений во время развития нервного стержня рыбок данио.
Обсуждение
Настоящая работа продемонстрировала, что гранулы PAAm, функционализированные PLL-Cy3, можно эффективно вводить в живую ткань / эмбрионы для количественного определения in vivo клеточных стрессов.Впервые надежная эталонная конфигурация была предложена для численного анализа деформаций бусинок, которые отклоняются от сферической формы in vivo . В результате с помощью метода COMPAX были восстановлены достоверные данные об изменении давления, а также о направлении основных изменений формы. Подробная механическая характеристика бусинок и детальный вычислительный анализ деформации бусинок in vivo выявили пульсирующие напряжения во время развития эмбриона рыбок данио.
Приготовление шариков из PAAm с использованием стандартизированной фокусировки микрожидкостного потока 28 привело к чрезвычайно узкому распределению по размерам, которое, насколько нам известно, не было достигнуто в других исследованиях.В общем, расчет изменений формы валика основан на знании ненапряженного состояния в качестве эталона. Мохагегян и др. . 27 показали, что эту эталонную конфигурацию можно точно определить путем удаления клеток во время нанесения in vitro альгинатных микросфер. Однако, поскольку это неосуществимо in vivo , исходное состояние после закачки использовалось для определения состояния без напряжений, что вносило неопределенности в расчет напряжений.Напротив, однородность размеров используемых здесь шариков PAAm была важна для того, чтобы сделать COMPAX нечувствительным к вариациям исходного размера и позволила применить этот подход к живым развивающимся тканям / животным в течение продолжительных периодов времени.
Модуль упругости шариков PAAm (~ 2 кПа) был подобен модулю упругости клеток или тканей, которые после инъекции в живую ткань / эмбрион позволяли окружающим клеткам деформировать шарики и, таким образом, позволяли проводить чувствительные исследования силы клеток при разные стадии эмбрионального развития рыбок данио.Поскольку знание эластичных свойств валика является важным условием для надежного анализа напряжений, мы провели обширные измерения характеристик материала непосредственно на валиках из PAAm. Для определения модуля Юнга шариков на различных этапах процесса функционализации PLL-Cy3 использовали индентирование коллоидного зонда на основе АСМ. Средний модуль Юнга гранул, модифицированных NHS, немного увеличился после модификации PLL-Cy3 из-за электростатических взаимодействий (дополнительных точек сшивания).PLL-Cy3 усиливает взаимодействие с клеточными мембранами (отрицательно заряженные ионы), а его флуоресцентная метка позволяет обнаруживать шарики с помощью конфокальной микроскопии. Модификация геля с помощью PLL привела к появлению положительных зарядов, которые могли изменить эластичность гранул, путем введения дополнительных точек сшивания в полимерную сеть 31 . После модификации шариков PLL-Cy3 все шарики стали гомогенно флуоресцентными и демонстрировали стабильную жесткость при температурах от комнатной до 50 ° C.
В большинстве исследований по использованию коллоидных микрогелей в качестве датчиков напряжения механическая характеристика тестовой системы проводилась на объемных гелях 27 , 32 . Здесь мы напрямую сравнили свойства шариков на макро- и микромасштабах. Были проведены испытания давлением на объемных гелях PAAm (идентичный составу, как у шариков), которые выявили аналогичные начальные модули упругости, определенные с помощью вдавливания на основе АСМ. Тем не менее, тесты объемного геля показали незначительные отклонения формы кривой по сравнению с измерениями АСМ, которые могли быть вызваны вариациями чувствительности к пористости гелей во время макро- и микромасштабных откликов.Более того, сравнение осевого поведения материала гелей PAAm с законом Неогука о материалах показало соответствие для деформаций до 10%. В этом диапазоне наблюдались деформации шариков ПААм. Одновременно был определен коэффициент Пуассона 0,443 28 . Это оправдывает применение неогуковского закона о сжимаемом материале, который позволяет обнаруживать объемные изменения, что исключено для несжимаемых шариков. Однако необходимо разработать новый нелинейный закон упругого материала, чтобы с равной точностью улавливать большие деформации, которые наблюдались локально в шариках.Этот вывод противоречит традиционному подходу предыдущих исследований, которые описывают датчики напряжения гидрогеля как линейно-упругие материалы. Результирующее численное моделирование ограничивалось геометрической линейностью — сценарий, который не позволял должным образом учитывать большие деформации. Кроме того, объемные испытания показали, что дальнейшие исследования материала на микромасштабе могут способствовать развитию более детального понимания механического поведения.Поскольку при вдавливании коллоидного зонда на основе АСМ анализировался модуль Юнга только для деформаций менее 10%, возрастающий наклон кривой деформация-напряжение от объемных испытаний не мог быть зафиксирован. Как макроскопические, так и микроскопические характеристики материала были предпосылкой для детального понимания поведения материала, что позволило нам свести к минимуму неопределенности при расчетах изотропных и анизотропных напряжений.
Численная проверка COMPAX показала хорошие результаты для всех сценариев нагрузки с четырьмя различными критериями, а также значительную точность при определении ориентации главного напряжения и среднего давления.С помощью COMPAX невозможно было количественно зафиксировать только распределение касательного напряжения, что можно объяснить расхождениями реального направления смещения с предполагаемой радиальной ориентацией. Чтобы повысить точность метода, флуоресцентные и высокодисперсные маркеры могут быть встроены в шарики, чтобы обеспечить точечную реконструкцию векторов смещения, по крайней мере, в положениях маркеров, и получить информацию о смещении объема в дополнение к смещениям поверхности. Аналогичный подход для восстановления деформаций формы с использованием флуоресцентных маркеров уже использовался для метода ERMG 27 .Однако из-за отсутствия эталонной конфигурации, соответствующей форме валика без напряжений, маркер нельзя было использовать для получения подробной информации о смещениях. Кроме того, потребуется другой подход для сопоставления маркеров в деформированной конфигурации с соответствующими маркерами в недеформированной конфигурации. Для этого используется несколько разных маркеров с заранее определенным расстоянием между собой, чтобы повторно идентифицировать ориентацию борта в деформированном состоянии и сопоставить высокодисперсные маркеры в недеформированной конфигурации.Эта модификация метода может служить для определения точной эталонной конфигурации недеформированного исходного валика и представляет собой существенное улучшение. Кроме того, деконволюция или многоугловая световая микроскопия дает возможность улучшить осевое разрешение COMPAX. Тем не менее, поскольку средний диаметр валика используется для построения недеформированной сферы, которая считалась эталонной геометрией для основного анализа КЭ, необходимо было учитывать неопределенность диаметра валика.Узкое распределение размеров изготовленных шариков из ПААм позволило нам ограничить стандартное отклонение соответствующего анализа неопределенности 30%. Имплантация флуоресцентных маркеров может еще больше уменьшить эту разницу.
Первоначальные наблюдения за распределением тканевого стресса у эмбрионов рыбок данио были возможны с помощью ERMG, сделанных из альгината, введенного в бластулу и на ранних стадиях гаструляции эмбрионального развития 27 . В этом исследовании авторы предоставили доказательства пространственных различий в растягивающих и сжимающих напряжениях на ранних стадиях развития ткани.Как продолжение предыдущего исследования, мы теперь показываем, что шарики PAAm могут быть использованы для количественной оценки изменений стрессов, генерируемых клетками во время нейруляции рыбок данио, динамического морфогенетического процесса, который трансформирует нервную пластинку в нервный стержень. Мы также показываем, что растягивающие и сжимающие напряжения возникают одновременно в разных положениях внутри развивающегося нервного стержня и что они совпадают с наблюдениями, полученными в ходе ранних исследований развития, в которых использовались ERMG. Важно отметить, что оба исследования показывают, что пространственные вариации могут возникать в преобладающих напряжениях во время формирования ткани.В настоящем исследовании мы также предоставляем доказательства того, что сжимающие напряжения могут доминировать в формировании нервного стержня между 14 и 20 часами позже. Такие сжимающие напряжения являются следствием устойчивой и плотной упаковки ткани и связанного с ней контроля нейрогенеза с помощью обратной связи на оси апикально-базальной полярности 33 .
Используя датчики напряжения шарика PAAm, мы впервые показываем различия в пространственном и временном распределении напряжения не только во время гаструляции, но и непосредственно внутри ткани во время формирования нервных стержней рыбок данио.Наблюдаемые пульсирующие изменения в относительных полях напряжения во время нейруляции могут быть результатом делений поляризованных клеток, особенно для бусинок, расположенных в нервном стержне при 14 hpf и 15 hpf. Такие ориентированные деления клеток происходят во время периода нейруляции нервных стержней рыбок данио и вызывают однородное распределение полярности в нервных стержнях посредством синхронизированных клеточных делений по средней линии 34 — 36 . По мере развития нейруляции тканевой поток в сочетании с изменением общей формы клеток 37 , движения клеток вдоль апикально-базальной оси 33 и удлинение оси 24 также могут быть причиной наблюдаемого распределения напряжения. .Наблюдаемые колебания хорошо разрешаются частотой дискретизации на рис. При 20 hpf и рис. Далее, амплитуда колебаний постепенно изменяется от больших колебаний при 14 hpf до небольших колебаний (и более низкой частоты) при 20 hpf (рис.) Или наоборот (рис.), Чего не произошло бы, если бы эффект был вызван случайным шумом. Колебания в морфогенетических процессах не редкость, и их следовало ожидать 38 . Хорошим примером являются хорошо задокументированные и понятные колебания клеток amnioserosa во время дорсального закрытия в морфогенезе Drosophila 39 , 40 .Таким образом, из-за биологических и морфогенетических процессов, происходящих в это время, мы считаем, что наблюдаемые изменения во времени являются настоящими колебаниями. Поскольку средние значения на момент времени не изменяются при усилении, дополнительно поддерживается индикация наличия значительных колебаний. На рис. Мы наблюдаем отклонение максимального нормального напряжения на 20-80% от одного момента времени к следующему моменту времени. Столь большие отклонения не наблюдались даже при виртуальном численном анализе, где анализировались преувеличенные сценарии.Следовательно, недостаточная точность самого COMPAX не может объяснить колебания. Вариации модуля упругости или радиуса от валика к валику (как проанализировано на дополнительном рисунке 4 ) также не могут быть связаны с шумом в этом отношении, потому что один и тот же валик анализируется во времени и, таким образом, влияние неправильного модуля или радиус будет постоянным в каждый момент времени. Остающийся потенциальный источник шума — это данные изображения и связанный с ними процесс сегментации. Однако, учитывая значительно деформированные валики, показанные на рис.можно ожидать, что смещения на границе будут на несколько порядков больше, чем изменение формы изображения в результате шума. Следовательно, значительные колебания, наблюдаемые для нормальных напряжений, также нельзя объяснить шумом в данных изображения. Кроме того, наши наблюдения также подразумевают, что влияние отдельных клеточных делений, связанных со всем развитием рыбы, вероятно, со временем снижается, поскольку мы демонстрируем преобладание глобального стрессового состояния над стрессовыми изменениями из-за локального развития и только незначительные изменения в распределении стресса в течение последовательного времени. точки.
В заключение, мы использовали шарики PAAm и COMPAX для количественной оценки сил сжатия в реальном времени и оценки направления основных изменений формы во время формирования нервных стержней in vivo у эмбрионов рыбок данио. Тот же принцип может быть применен к другим областям применения для исследования преобладающих стрессов in vivo и in vitro 2 , 41 . С точки зрения биологии развития, дальнейшие исследования стрессов, действующих в тканях / организмах на раннем или позднем этапе развития, а также у взрослых животных, могут быть рассмотрены с помощью этой системы.Более того, изучение стрессовых изменений в культивируемых клетках, органоидах или монослоях предоставит дополнительные знания о механических аспектах межклеточных взаимодействий. Также на уровне отдельных клеток могут быть обнаружены такие процессы, как миграция или фагоцитоз, когда гранулы встречаются с отдельными клетками. Универсальность этого подхода недавно была продемонстрирована Vorselen et al. ., Которые использовали тот же общий подход для количественной оценки сил, генерируемых макрофагами во время фагоцитоза шариков PAAm 42 .Мы прогнозируем, что можно представить себе множество других приложений, в которых количественная оценка стрессов на уровне клеток улучшит наше понимание роли механики в биологии и медицине.
Методы
Изготовление и модификация шариков из PAAm
Изготовление шариков из PAAm с использованием микрожидкостного устройства, а также их последующая функционализация с помощью PLL были подробно описаны в другом месте Girado et al . 28 . Вкратце, создание шариков PAAm, которые были достаточно податливыми, чтобы допускать деформации, вызываемые клеточной силой, и одновременно позволяло удобное обращение во время микроинъекции, было достигнуто с использованием общей концентрации мономера акриламида (AAm) и бис-акриламида (BIS). из 7.9%. В процессе производства капли PAAm функционализировали NHS-эфиром, чтобы сделать возможным их модификацию с помощью поли-L-лизина (PLL), конъюгированного с флуорофорами Cy3 (NANOCS). Концентрация PLL-Cy3 28 пг / шарик была использована для обеспечения гомогенной пептидной функционализации.
Атомно-силовая микроскопия (АСМ)
Измерения индентирования АСМ проводили с использованием АСМ Nanowizard I (JPK Instruments), установленного на инвертированном оптическом микроскопе (Axiovert 200, Zeiss). Бесконечная консоль (Arrow TL-1, номинальная жесткость пружины k = 0.035–0,045 Н / м, NanoAndMore GmbH), снабженный микросферой из полистирола (диаметр: 5 мкм, Microparticles GmbH). Для приклеивания микросферы к концу кантилевера использовался двухкомпонентный эпоксидный клей (аралдит). Перед экспериментом кантилевер был откалиброван методом тепловых шумов. Для вдавливания кончик кантилевера был выровнен по центру валика, и отдельные кривые сила-расстояние были получены со скоростью приближения 5 мкм / с и с контактной силой 2 нН (типичная глубина вдавливания: 1 мкм).Извлечение модуля Юнга валиков было реализовано путем подгонки кривой приближения к силе-расстоянию с моделью Герца для сферического индентора и применения коррекции двойного контакта с учетом дополнительной деформации, возникающей из-за противодавления на нижней стороне валика во время вдавливания. 28 , 43 , 44 . Раствор клеточно-адгезивного белка (CellTak, Cell and Tissue Adhesive, Corning) использовали для иммобилизации шариков PAAm на дне чашки Петри, чтобы предотвратить движение шариков во время эксперимента.Модуль Юнга определяли с использованием программного обеспечения для обработки данных JPK (JPK Instruments). Измерения проводили в PBS и при комнатной температуре, за исключением испытаний на стабильность температуры, когда температура была установлена на 24 ° C, 30 ° C, 37 ° C, 44 ° C и 50 ° C соответственно. Для измерений АСМ в сочетании с конфокальной флуоресцентной микроскопией использовались идентичные настройки и параметры АСМ в сочетании с конфокальным микроскопом (Zeiss 510 Meta).
Измерение модуля объемной упругости шариков из ПААм
Осмотическое напряжение сжатия для определения модуля объемной упругости шариков из ПААм вызывали PBS с добавлением декстрана, меченного флуоресцеином (молекулярная масса 2 МДа, Sigma Aldrich 52471-1 G).Четко определенные количества декстрана использовались для обеспечения контролируемого приложения осмотического стресса 25 , 30 . Трехмерная форма шариков PAAm была зафиксирована с помощью инвертированного конфокального микроскопа (Zeiss LSM700) до и через 30 минут после воздействия раствора декстрана, а объем шариков PAAm был проанализирован с использованием программного обеспечения с открытым исходным кодом Fiji (счетчик трехмерных изображений ) 45 .
Реометр
Для реологических измерений использовали пластинчатый реометр (ARES Rheometer, Rhemetric Scientific).Полностью набухшие объемные гели PAAm (концентрация мономера: 7,9%, диаметр геля 1 см) прессовали до деформации 60% при комнатной температуре.
Формирование агрегатов МСК
Иммортализованные мезенхимальные стромальные клетки (МСК), иммортализованные теломеразой обратной транскриптазы человека (hTERT), трансдуцировали согласно Girardo et al . 28 . и поддерживали в увлажненной атмосфере 5% CO 2 в среде Игла, модифицированной Дульбекко с низким содержанием глюкозы (DMEM, Gibco), обогащенной 10% фетальной телячьей сывороткой (Gibco, Invitrogen).Для образования многоклеточных агрегатов МСК в суспензии смешивали с функционализированными PLL-Cy3 гранулами PAAm и культивировали в форме капель по 70 мкл на перевернутых крышках чашек Петри в течение 24 часов, 48 часов и 14 дней в соответствии с классическим методом висящих капель.
Численное моделирование
Конфокальные изображения были импортированы в программу трехмерной визуализации и обработки Avizo. При этом бусинка была сегментирована на каждом изображении с использованием инструментов сегментации e. г., пороговая. На основе сегментации была интерполирована трехмерная геометрия, а затем была построена сетка КЭ.Все симуляции проводились в ABAQUS, коммерческом программном обеспечении для конечных элементов, которое обеспечивает неогуковский закон материалов в качестве внутренней подпрограммы.
Все расчеты напряжений были основаны на тензоре напряжений Коши σ. Контурные графики микрошариков PAAm показывают распределение поверхностного давления, которое определяется как σPres = -13tr (σ). Дальнейшие оценки метода COMPAX были основаны на объемном среднем тензоре напряжений Коши σ0, который был вычислен по формулам
σØ = ∑i = 1neσievie∑i = 1nevie,
, где σe — тензор напряжений Коши при однократном интегрировании. точка внутри конечных элементов, а v e — соответствующий объем.Мы обозначили главное напряжение объемного среднего тензора напряжений Коши как σiØ с i = [1,3] и средним объемным давлением σPresØ.
Приближение среднего объемного давления σPresØ можно вычислить как σPresØ = −κVc − VrVr, где κ представляет собой объемный модуль упругости, В c — это объем текущей конфигурации, а В r — объем эталонной конфигурации. Однако из-за нелинейностей, включенных в модель Нео-Гука, изменение объема, локально меняющееся внутри бусинки, вызовет локально изменяющееся нелинейное давление.Его среднее значение объема не обязательно совпадает с оценкой основного закона в общем масштабе бусинок, то есть σPres0 = -κVc-VrVr, хотя изменение объема Vc-VrVr фактически равно среднему значению локальных изменений объема.
Значения сравнения ΔσiØ и ΔσPresØ / σPres, refØ, которые участвовали в численной проверке, определены как
ΔσiØ = σi, CMXØ − σi, refØ,
ΔσPresØσPres, refØ = σPres, CMXØ − σPres, refØ = σPres, CMXØ − σPres, ref refØ,
, где (•) ref и (•) CMX представляют собой маркировку значений, связанных с эталонным моделированием и методом COMPAX, соответственно.
Линия и содержание рыбок данио
Эмбрионы и взрослые особи рыбок данио (Danio rerio) были получены, выращены и сохранены, как описано ранее 46 , 47 . Эмбрионы были расположены в часах после оплодотворения (hpf) 48 . Для получения эмбрионов eGFP с мембранной меткой взрослых из трансгенного штамма Tg (Bactin: HRas-eGFP) (ZDB-ALT-061107-2) 49 скрещивали с таковыми из штамма AB дикого типа. Более того, трансгенная линия, которая экспрессировала нацеленный на ядро венерический флуоресцентный белок в локусе otx2 (knock-in), была создана с использованием стратегии CRISPR knock-in, как описано ранее 50 ; эта линия была использована для определения границы среднего мозга и заднего мозга.
Все эксперименты на животных проводились в соответствии с законами о благополучии животных и требованиями местных властей (Landesdirektion Sachsen, Германия) и выполнялись в соответствии с соответствующими директивами и правилами. Протоколы генерации (24-9168.11-1 / 2013-14) и обслуживания (DD24-5131 / 346/11 и DD24-5131 / 346/12) и экспериментов с трансгенными животными (24-9168.24-1 / 2014-4 ) также были надлежащим образом утверждены и выполнялись в соответствии с соответствующими директивами и правилами (Landesdirektion Sachsen, Германия).Во всех экспериментах использовались эмбрионы рыбок данио только до 120 часов после оплодотворения, которые не подпадают под эксперименты на животных (Директива 2010/63 / ЕС и в соответствии с немецким законом о защите животных и Landesdirektion Sachsen, Германия). Взрослых трансгенных животных использовали только для поддержания трансгенных линий и целей разведения.
Микроинъекция рыбок данио
Эмбрионы выращивали в инкубаторе с температурой 28,5 ° C, дехорионировали через 9 часов после оплодотворения с использованием проназы (Sigma-Aldrich, P8811) и инкубировали в растворе Рингера без кальция (рецепт из базы данных информационной сети по рыбкам данио (ZFIN); http: // zfin.org) в течение 10 минут. Имплантация бусинок проводилась в том же растворе. Стандартные боросиликатные капилляры без филамента (World Precision Instruments) вытягивали с помощью съемника для микропипеток (Sutter Instruments). Кончики были вырезаны, чтобы получить отверстие размером около 15 мкм, и обратно загружены инъекционным раствором, содержащим шарики гидрогеля. Гранулы имплантировали в развивающуюся нервную пластинку рядом с предполагаемой границей среднего мозга и заднего мозга с помощью системы микроинжектора (PV820, пневматический пиконасос, World Precision Instruments).Введенные эмбрионы инкубировали в буфере E2 (рецепт из протокола ZFIN) до визуализации. Имплантация бусинок не привела к морфологическим отклонениям или отклонениям в развитии. Рыбы были предварительно проверены на успешную имплантацию в желаемом месте. Отобранные эмбрионы были закреплены, как описано ниже, и визуализированы.
Монтаж и визуализация эмбрионов
Эмбрионы с шариками в желаемом месте анестезировали с помощью MS-222 (Sigma Aldrich, A5040) в растворе E2 и устанавливали дорсально на чашку Петри со стеклянным дном (MatTek) в 1% агарозе с низкой температурой плавления, приготовленной в Раствор Е2 (рис.). Покадровые изображения получали с помощью инвертированного конфокального микроскопа (Zeiss LSM780) с использованием водно-иммерсионного объектива с 40-кратным увеличением (NA 1,2) с лазерными линиями 488 нм для eGFP и 561 нм для Cy3. Изображения были проанализированы с использованием программного обеспечения с открытым исходным кодом FIJI 43 .
Статистический анализ
Ширина интервалов гистограммы (рис.) Была выбрана в соответствии с правилом Фридмана-Диакониса 51 . На прямоугольных диаграммах (Рис.; Дополнительный Рис. 4b ) среднее значение показано как закрашенный квадратный символ, медиана — как прямая линия, а прямоугольники определяются 25 процентилями -го и 75 -го .Усы представляют собой стандартное отклонение, а процентили 1 и 99 обозначены крестиками на рис. На рис. Точки данных с полосами ошибок указывают среднее ± стандартное отклонение. Количество измерений ( n ) указано в соответствующих полях точек данных (Рис.; Дополнительный Рис. 4b ) и в описании рисунка (Рис.), Соответственно. Данные на рис. И дополнительном рис. 4b были проанализированы с использованием программного обеспечения OriginPro. Оба набора данных отклоняются нормально (тест Шапиро-Уилка).Для оценки статистической разницы использовался непараметрический критерий Вилкоксона-Манна-Уитни. Звездочки определяют статистическую разницу следующим образом: *** P <0,001.
Дополнительная информация
Благодарности
Мы благодарим центр микроструктуры и световой микроскопии (частично финансируемый землей Саксония и Европейским фондом регионального развития — EFRE) Центра молекулярной и клеточной биоинженерии Технического университета Дрездена за производство шариков и техническая поддержка конфокальной микроскопии соответственно.Мы благодарим Анжелу Якоби (Биотехнологический центр, TUD) за предоставление иммортализованных мезенхимальных стромальных клеток (МСК) человеческой теломеразы обратной транскриптазы (hTERT). Мы благодарим Петру Вельцель (IPF, Дрезден) за помощь с реометром. Мы благодарим Элизабет Фишер-Фридрих (Биотехнологический центр, TUD) за разрешение использовать АСМ в сочетании с конфокальным микроскопом. Мы благодарим Марику Фишер, Джитку Михлинг и Даниэлу Мегель за заботу о рыбках данио. Мы благодарим доктора Васупраду Айенгара за редактирование языка и содержания.Эта работа также была поддержана расширенным грантом ERC (Zf-BrainReg) и грантами на проекты Немецкого исследовательского фонда (Deutsche Forschungsgemeinschaft, номер проекта BR 1746 / 6-1 и BR 1746/3), предоставленные M.B. Мы с благодарностью признаем финансовую поддержку со стороны Фонда Александра фон Гумбольдта (профессора Александра фон Гумбольдта для J.G.)
Вклад авторов
J.G., D.B., M.B. и C.W. контролировали и определяли проект; Н.Т., Г.К. и К.Б. разработал процедуру инъекции шариков; Н.T. микроинъектировал шарики в эмбрионы рыбок данио; К.У. и Д. разработал вычислительный анализ, Н. и К. механически охарактеризовали бусинки; N.T. и J.F. провели агрегированные эксперименты MSC; S.G. разработан, а R.G. подготовили шарики из ПААм; Г.К. и М. предоставил эмбрионы рыбок данио и помог с интерпретацией данных; N.T. и К.У. написал статью с помощью Д. и Дж.
Конкурирующие интересы
Авторы заявляют об отсутствии конкурирующих интересов.
Сноски
Примечание издателя Springer Nature сохраняет нейтралитет в отношении юрисдикционных претензий в опубликованных картах и о принадлежности организаций.
Эти авторы внесли равный вклад: Н. Требер и К. Ульманн.
Дополнительная информация
доступна для этой статьи по адресу 10.1038 / s41598-019-53425-6.
Ссылки
1. Roca-Cusachs P, Conte V, Trepat X. Количественная оценка сил в клеточной биологии. Nat. Cell Biol. 2017; 19: 742–751. DOI: 10,1038 / ncb3564. [PubMed] [CrossRef] [Google Scholar] 2. Trepat X и др. Физические силы при коллективной миграции клеток. Nat. Phys. 2009. 5: 426–430. DOI: 10,1038 / нфиз1269.[CrossRef] [Google Scholar] 6. Blanchard GB, et al. Тектоника тканей: скорость морфогенетической деформации, изменение формы клеток и интеркаляция. Nat. Publ. Gr. 2009. 6: 458–464. [Бесплатная статья PMC] [PubMed] [Google Scholar] 7. Лекит Т., Ленне П.Ф. Механика клеточной поверхности и контроль формы клеток, структуры тканей и морфогенеза. Nat. Rev. Mol. Cell Biol. 2007; 8: 633–644. DOI: 10.1038 / nrm2222. [PubMed] [CrossRef] [Google Scholar] 8. Нельсон CM, Gleghorn JP. Скульптурные органы: механическая регуляция развития тканей.Анну. Преподобный Биомед. Англ. 2012; 14: 129–154. DOI: 10.1146 / annurev-bioeng-071811-150043. [PubMed] [CrossRef] [Google Scholar] 10. Вебер И. П., Юн Ш., Скарчелли Г., Франце К. Роль плотности клеточного тела в механике сетчатки жвачных животных, оцененная с помощью атомной силы и микроскопии Бриллюэна. Phys. Биол. 2017; 14: 065006. DOI: 10.1088 / 1478-3975 / aa6d18. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 11. Гейзенберг С.П., Беллаиш Ю. Силы в морфогенезе и формировании паттерна тканей. Клетка. 2013; 153: 948–62. DOI: 10.1016 / j.cell.2013.05.008. [PubMed] [CrossRef] [Google Scholar] 12. Хаазе К., Пеллинг А. Исследование клеточной механики с помощью атомно-силовой микроскопии. Microsc. Анальный. 2014; 12: 6–9. [Google Scholar] 13. Кирмизис Д., Логотетидис С. Зондирование с помощью атомно-силовой микроскопии в измерении клеточной механики. Int. J. Nanomedicine. 2010. 5: 137–145. DOI: 10.2147 / IJN.S5787. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 14. Hochmuth RM. Микропипетка для аспирации живых клеток. J. Biomech. 2000; 33: 15–22. DOI: 10.1016 / S0021-9290 (99) 00175-X.[PubMed] [CrossRef] [Google Scholar] 15. Хан SJ, Oak Y, Groisman A, Danuser G. Тяговая микроскопия для выявления модуляции силы в адгезиях с субразрешением. Nat. Методы. 2015; 12: 653–656. DOI: 10,1038 / Nmeth.3430. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 16. Tan JL, et al. Клетки, лежащие на ложе из микроигл: способ изолировать механическую силу. Proc. Natl. Акад. Sci. 2003; 100: 1484–1489. DOI: 10.1073 / pnas.0235407100. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 18. Сугимура К., Ленне П.Ф., Гранер Ф.Измерение сил и напряжений in situ в живых тканях. Разработка. 2016; 143: 186–96. DOI: 10.1242 / dev.119776. [PubMed] [CrossRef] [Google Scholar] 22. Grashoff C, et al. Измерение механического натяжения винкулина выявляет регуляцию динамики фокальной адгезии. Природа. 2010; 466: 263–266. DOI: 10,1038 / природа09198. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 25. Dolega ME, et al. Ячеистые датчики давления обнаруживают увеличение механического напряжения по направлению к сердцевине многоклеточных сфероидов при сжатии.Nat. Commun. 2017; 8: 1–9. DOI: 10,1038 / ncomms14056. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 26. Ли В. и др. Датчики силы диспергируемого гидрогеля выявляют закономерности твердого механического напряжения в многоклеточных сфероидных культурах. Nat. Commun. 2019; 10: 1–14. DOI: 10.1038 / s41467-018-07882-8. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 27. Mohagheghian E, et al. Количественное определение сил сжатия между слоями живых клеток и внутри тканей с помощью эластичных круглых микрогелей. Nat. Commun.2018; 9: 1878. DOI: 10.1038 / s41467-018-04245-1. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]28. Girardo, S. et al. . Стандартизированные микрогелевые шарики в качестве механических зондов для эластичных клеток. Дж . Материал . Chem , 179–185 (2018).
30. Monnier S, et al. Влияние осмотического стресса на многоклеточные агрегаты. Методы. 2016; 94: 114–119. DOI: 10.1016 / j.ymeth.2015.07.009. [PubMed] [CrossRef] [Google Scholar] 31. Okay O, Durmaz S. Зависимость модуля упругости сильных полиэлектролитных гидрогелей от плотности заряда.Полимер (Guildf). 2001; 43: 1215–1221. DOI: 10.1016 / S0032-3861 (01) 00723-6. [CrossRef] [Google Scholar] 32. Хуанг Дж., Ван Л., Сюн С., Юань Ф. Эластичный гидрогель как датчик для обнаружения механического напряжения, создаваемого отдельными клетками, выращенными в трехмерной среде. Биоматериалы. 2016; 98: 103–112. DOI: 10.1016 / j.biomaterials.2016.04.024. [PubMed] [CrossRef] [Google Scholar] 33. Хискок Т.В., Мисфельд Дж. Б., Мосалиганти К. Р., Линк Б. А., Мегасон С. Г.. Обратная связь между упаковкой тканей и нейрогенезом в нервной трубке рыбок данио.Разработка. 2018; 145: dev157040. DOI: 10.1242 / dev.157040. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 34. Виджайрагаван Д.С., Дэвидсон Л.А. Механика нейруляции: от классических до современных взглядов на физическую механику, которая формирует, складывает и формирует нервную трубку. Врожденные дефекты Res. 2016; 109: 153–168. DOI: 10.1002 / bdra.23557. [PubMed] [CrossRef] [Google Scholar] 35. Арая К., Уорд Л.С., Гирдлер Г.К. И Миранда, М. Координация клеточного и тканевого поведения во время морфогенеза нервной трубки у рыбок данио.Dev. Дин. 2016; 245: 197–208. DOI: 10.1002 / dvdy.24304. [PubMed] [CrossRef] [Google Scholar] 36. Hong E, Brewster R. N-кадгерин необходим для поведения поляризованных клеток, которое управляет нейруляцией у рыбок данио. Разработка. 2006; 3905: 3895–3905. DOI: 10.1242 / dev.02560. [PubMed] [CrossRef] [Google Scholar] 37. Gutzmann JH, Sive H. Эпителиальная релаксация, опосредованная регулятором миозинфосфатазы Mypt1, необходима для расширения просвета желудочков мозга и морфогенеза заднего мозга. Разработка. 2010; 137: 795–804.DOI: 10.1242 / dev.042705. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 38. Лин СЗ, Ли Б., Лан Джи, Фэн XQ. Активация и синхронизация осцилляторной морфодинамики в многоклеточном монослое. Proc. Natl. Акад. Sci. США. 2017; 114: 8157–8162. DOI: 10.1073 / pnas.17054. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 39. Соколов А., Тояма Ю., Кихарт Д.П., Эдвардс Г.С. Ингрессия клеток и колебания апикальной формы во время дорсального закрытия у Drosophila. Биофиз. J. 2012; 102: 969–979.DOI: 10.1016 / j.bpj.2012.01.027. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 40. Dierkes K, Sumi A, Solon J, Salbreux G. Спонтанные колебания упругих сократительных материалов с оборотом. Phys. Rev. Lett. 2014; 113: 1–5. DOI: 10.1103 / PhysRevLett.113.148102. [PubMed] [CrossRef] [Google Scholar] 41. Палуч, Э. и Гейзенберг, К. Биология и физика изменений формы клеток в обзоре развития. 790–799. [PubMed]
42. Vorselen, D. et al. . Сверхразрешенная микроскопия силы тяги микрочастиц без эталона (MP-TFM) выявляет сложность механического взаимодействия при фагоцитозе. bioRxiv 431221 (2018).
43. Glaubitz M, et al. Новая контактная модель для экспериментов по вдавливанию в АСМ мягких сферических ячеистых частиц. Мягкая материя. 2014; 10: 6732. DOI: 10.1039 / C4SM00788C. [PubMed] [CrossRef] [Google Scholar] 44. Докукин М.Е., Гуз Н.В., Соколов И. Количественное исследование модуля упругости слабо прикрепленных клеток в экспериментах по индентированию АСМ. Биофиз. J. 2013; 104: 2123–2131. DOI: 10.1016 / j.bpj.2013.04.019. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]46.Вестерфилд, М. Книга о рыбках данио. Руководство по лабораторному использованию рыбок данио (Danio rerio). (Издательство Орегонского университета, 2000 г.).
47. Бранд, М., Гранато, М. Содержание и разведение рыбок данио. в Данио: Практический подход, 7–37 (2002).
48. Киммел С.Б., Баллард В.В., Киммел С.Р., Ульманн Б., Шиллинг Т.Ф. Этапы эмбрионального развития рыбок данио. Dev. Дин. Выкл. общественность. 1995; 203: 253–310. DOI: 10.1002 / aja.1002030302. [PubMed] [CrossRef] [Google Scholar] 49. Купер М.С. и др. Визуализация морфогенеза у трансгенных эмбрионов рыбок данио с использованием красителя метилового эфира BODIPY TR в качестве жизненно важного контрастного красителя для GFP.Dev. Дин. 2005. 232: 359–368. DOI: 10.1002 / dvdy.20252. [PubMed] [CrossRef] [Google Scholar] 50. Кесаван Г., Чекуру А., Мачате А., Брэнд М. CRISPR / Cas9-опосредованное включение рыбок данио как новая стратегия изучения развития границ среднего и заднего мозга. Фронт. Нейроанат. 2017; 11: 1–14. DOI: 10.3389 / fnana.2017.00052. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 51. Фридман Д., Диаконис П. О гистограмме как оценщике плотности: теория L 2. Zeitschrift für Wahrscheinlichkeitstheorie und Verwandte Gebiete.1981; 57: 453–476. DOI: 10.1007 / BF01025868. [CrossRef] [Google Scholar]Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie.Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie.Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Объемные фигурки из бисера светлые. Вышивка бисером животные
Каждый задумывается о том, как с помощью чего-то маленького сделать собственный образ неповторимым и необычным, добавить уюта в интерьер, порадовать родных и близких или развлечь ребенка в свободный день. Все эти сложные на первый взгляд, есть очень простое решение. Оригинал I. Хорошее решение Милыми бусинками могут стать зверюшки. В такой работе помогут схемы зверушек из бисера, и рассмотрим их в этой статье.
Варианты применения
Маленькие модели, анимированные из бусинок, существует огромное количество способов нанесения. Самые распространенные брелки для ключей. Ключи с охранником в виде льва или собаки будут смотреться очень оригинально и интересно. А фигурки котиков и медвежат будут смотреться очень мило и красиво.
Сфера использования маленьких фигурок очень разнообразна. В первую очередь на ум приходят брелки для ключей. Очень необычно выглядит лев или собачка из охраняемых бус, не правда ли? Да и аккуратные фигурки котиков и мишек смотрятся на клавишах потрясающе.
Еще такие зверюшки хорошо смотрятся в виде подвеса. Для этого лучше создавать объемные изделия, которые будут привлекать взгляды и создавать настроение.
Зверюшки из бисера можно использовать в виде брошек. Красивые бабочки или стрекозы будут элегантно сочетаться с кофточками и придадут изюминку. Их можно использовать как декоративный элемент для украшения главного подарка или части интерьера, если сделать их крупнее. С помощью объемной техники в зоопарке можно создавать игрушки для детей, а также из них можно создавать животных и своими руками, ведь они несложны в исполнении и для начинающих.
Световые схемы
Потребуются следующие материалы и инструменты:
- Бусины подходят под выбранные животные окрасы;
- Леске, проволока или нить;
- Иголка для вышивки бисером;
- Аксессуары для идеи: крючки, кольца и др.
Чаще всего фигурки зверюшек делают на проволоке, потому что она отлично держит форму, или на леске. Помимо вышеперечисленного, еще потребуется схема создания выбранного зверька.Без схематичного изображения новичка легко запутать.
Берем леску, проволоку или нитки до метра в зависимости от выбранной фигуры и размера будущего зверька. Складываем отрезок пополам, по центру закрепляем шпилькой, также можно использовать крючок для брелока, как показано на фото ниже. Изначально мы проделали два конца лески через первые пивные банки. Однако учтите, что для всех животных сначала необходимо разное количество пива в начальном ряду.
Ниже приведены несколько схематических изображений, для которых будут получены плоские звери.
Забавная лягушка:
Грозный Лионок:
Потрясающий паук:
Трудолюбивая пчела:
Милая черепаха:
Красивая бабочка:
Мудрый Совис:
Розовый фламинго:
Яркий попугай:
Кенгуренок игривый:
Хороший крокодил:
Милый котенок:
Божья коровка:
Прекрасные овцы:
Необычная ящерица:
Интересный пингвин:
Храбрый щенок:
Машины объемные
Объемные модели зверей из бусинок можно использовать как игрушки, брелоки, подвески, статуэтки и многое другое.В настоящее время изобретено огромное количество схем и форм объемных животных. Разберем подробно на мастер-классе, как создать тигра в этой технике.
Необходимые материалы и инструменты:
- Бусины коричневого, белого, черного и оранжевого цветов;
- Бусины;
- Иголка для вышивки бисером;
- Проволока.
Такого тигра нужно создать в технике мозаики.
Вначале плетем тигровую щеку.Для этого берем проволоку и набираем бусину, снова через нее фиксируем проволокой. Для щек потребуются бусинки белого цвета и две бусинки черного цвета. Создав две части щек, скрещиваем их мозаичным швом.
Берем четырнадцать коричневых бусинок и мозаичным плетением делаем носик. После соединяем его со щеками.
Теперь берем бусинки оранжевого цвета Набираем по кругу с двух сторон носа. Делаем так четыре ряда чисто бусинки оранжевого цвета, затем добавляем черную бусину, делая глазки тигровыми.Затем голова животного на голове по кругам, попеременно катается на бусинах черного и оранжевого цвета, таким образом появляются полосы тигра.
После этого берем бусинки белого и оранжевого цвета и квадратным плетением делаем ушки. Каждое ухо состоит из двух частей, белого и оранжевого цвета, после чего их нужно соединить и наклеить в круг из оранжевых бусинок. Готовые ушки прикрепите к голове тигра.
С помощью белых бусин создаем нижнюю челюсть, на которой делаем язычок из шести красных бисперов.После этого прикрепите его к голове.
С помощью оранжевых, белых и черных бусинок плачет полосатый торс тигра. Через семнадцать рядов начинаем убавлять количество говядины с боков, а затем с лицевых. Факел шевелится, а животик белый.
А теперь пора сплести тигру четыре лапы. Делаем шестнадцать рядов и подошв, которые потом соединяем швом мозаики лапкой. В самом конце делаем хвостик. Он похож на квадратную сбрую. Осталось только соединить все взятые между собой детали, и выйдет милый тигренок.
Видео по теме
Рассмотренные схемы и технологии далеко не единственные, есть еще много других, для дальнейшего развития навыков предлагаем еще несколько видео с уроками по созданию разных зверей.
Плетение из бисера — одно из древних декоративно-прикладных искусств. Плетут бусы на африканском континенте, и сегодня он известен во всем мире.
Новичкам плетения бисером могут открыться небывалые просторы для творчества.Чего мы не увидим от мастеров этого замечательного искусства: и елочки из бисера, и игрушки из бисера, и бижутерия, и декоративные аксессуары для дома, и многое другое.
Плоские и объемные зверушки из бисера
Поделки из бисера Новичкам рекомендуется делать по готовым схемам — это поможет не ошибиться в подсчете бус, последовательностях приема. Такие схемы плетения из бисера могут быть предназначены для так называемых 2D, то есть плоских, и 3d, то есть объемных поделок. Рекомендуется заниматься с плоскими изделиями.
Одними из любимых схем вышивания бисером у начинающих являются схемы плетения игрушек животных. Такие забавные я. Красивые игрушки Вы можете украсить свой дом или порадовать детей. Существуют схемы плетения животных из бисера для начинающих с разным уровнем подготовки.
Плетение животных бисером и схемы к ним для начинающих
Например, вы можете взлететь на симпатичного крокодила. Для плетения изделия размером 9х12 понадобится 125 штук зеленого бисера, 150 желтых пивных, 1 черная, 2 ярких (синяя, красная и др.)), леска. Требуемая длина утечки рассчитывается исходя из размера буртиков. Для больших бусинок 1,75 м леска 0,25-0,3 мм. Для бусинки среднего размера — 1,1 м леска 0,2-0,25 мм.
Крокодил выполнен в технике параллельного плетения. Чтобы выполнить параллельное плетение на леске, сразу скатывают бисперы первого и второго рядов. Затем один конец рабочей нити продеваем через все бисеры второго ряда в сторону другого конца. После этого оба конца лески следует тщательно натянуть «до упора» так, чтобы все бисперы оказались посередине лески.
Полная схема плетения крокодила из бисера представлена ниже (рис. 1).
Таким образом, т.е. в технике параллельного плетения можно взвесить других забавных животных — черепаху (рис. 2), собаку (рис. 3), паука (рис. 4). Если изделие должно сохранять форму (как, например, паук и его «лапки»), то плетение бус выполняется на проволоке.
Вышивка бисером — род искусства, к которому подвешены и взрослые, и детские. Приобретя в магазине необходимые инструменты и материалы для рукоделия, можно за считанные минуты изготовить небольшой шедевр.Если вы давно задумывались о том, как сделать бусинки животных, обратите внимание на подробные схемы и описания нескольких техник.
Инструменты для плетения объемных поделок
Стандартный набор материалов для изготовления состоит из проволоки или рыбалки, игл, ножниц или плоскогубцев, а также бусин разного диаметра. Приступая к работе с объемными зверюшками, запаситесь натуральной или искусственной ватой для наполнения готовых изделий, чтобы они выглядели как натуральные. Не забудьте обзавестись кисточкой, которая понадобится для ухода за поделкой.Избегайте попадания воды, иначе продукт скоро выметется.
В магазинах для рукоделия взгляд посетителей радует не только разнообразие материалов, с помощью которых можно сделать изделие на любой вкус. Соблазн появляется в тот момент, когда на выходе появляются готовые объемные зверюшки из бисера, которые поражают своей красотой и оригинальностью. Медведи, подлые, поросята — любые схемы можно найти в книгах по рукоделию или придумать сами.Если вы уже приобрели необходимые инструменты и материалы и решили приступить к работе, полезные рекомендации помогут избежать типичных ошибок при плетении.
- Всегда следует начинать с самой большой части тела животных, чтобы в случае неправильно подобранного размера мелких частей можно было их подогнать.
- Не стоит выбирать бусины, расписанные сверху, иначе изделие со временем заберет или напоится.
- Набейте готового зверька натуральной или синтетической шерстью, чтобы самолет приобрел желаемый объем.
Брелок Krocodile
Упражнение выполняется в технике параллельного плетения на сплошной леске или проволоке. Маленький милый крокодил — это то, что вы мечтаете о том, чтобы на ключ были почти все рукодельницы. Объемные зверюшки из бусинок выглядят очень эффектно и смогут в любой момент поднять настроение, на них стоит просто взглянуть.
Для плетения крокодила потребуется бусинка только одного цвета — зеленого цвета, а также две большие бусинки для глаз.Начинаем изготовление поделки с хвоста. Возьмите несколько бусинок — в зависимости от толщины тела рептилии — и пропустите их через оба конца проволоки. После седьмого ряда отправьте первую пару стоп, а еще шесть — вторую. Возьмите петлю к хвосту или носику, чтобы использовать крокодила как брелок.
Ящики зверюшек из бисера (объем): Подробное описание
Глядя на этих миниатюрных котиков, обезьянок, зайчиков и поросят, хочется взять в руки инструменты и приступить к их изготовлению.На каждое животное у вас будет не более пятнадцати минут, а подробная схема ускорит процесс.
- Обезьяна. Начинайте рвать 7 белых бисеринок — это первый ряд, следующие шесть рядов состоят из девяти бисеринок. Ближе к концу поделки уши обезьянки потрите.
- Панда, свинья, котенок. Подшипники из бамбукового борта — точная копия современности. Как и обезьяна, он состоит из восьми рядов. Ушки — обычные петли.Поросята и котенок — зверюшки из бисера, схема плетения которых практически идентична.
- Попугай, олень. Сложность этих изделий заключается в приподнятых частях — лошадиных силах и рогах. Производство попугая и оленя, как и предыдущих вариантов, следует начинать снизу.
- Заяц, морж, лисица. Схемы этих милых зверюшек уникальны в своем роде. На голову зайца в технике параллельного плетения в самом конце отправлены огромные ушки, а застежки сделаны из плотной черной проволоки.Морж — единственное упражнение, плетение которого нужно начинать сверху вниз, чтобы было удобнее прикреплять клыки.
Мышь из бисера
Когда вы научитесь плести крокодила, вы легко сможете подарить другим животным из бисера. У очаровательной белой мышки не делятся голова и туловище. Сплетница звонилки из белого, серого или черного бисера (в технике параллельного плетения) длиной не более двадцати рядов, не забываем про хвостик и ушки.Затем сделайте розовое или желтое брюшко такого же размера и соедините обе стороны. Так просто мышку сплести.
Техника «Параллельное плетение» для изготовления объемных зверушек
Крокодил и другие миниатюрные зверушки из бисера, схемы плетения которых представлены выше, несмотря на разный внешний вид, изготавливаются по одному принципу. В этой технике можно делать украшения и даже цветы, настолько она универсальна. На проволоку наматывают одну бусину и закрепляют двумя концами проволоки, затем двумя.В зависимости от ширины изделия вначале можно вбивать бус больше, как на схемах обезьяны, свиньи, панды и других. Поскольку проволока — материал довольно плотный, рекомендуется сразу отрезать нужный кусок для изготовления изделия, чтобы впоследствии не пришлось его доставать. Если вы хотите сделать зверька двусторонним, необходимо взвесить лицевую и заднюю части, а затем совместить их. Как это сделать, указано на схеме выше.
Тигренок из бисера в технике «Кирпич»
Освоив этот метод плетения, вы с легкостью сможете создавать не только примитивные браслеты и другие украшения, но и такие поделки и сувениры, как звери из бисера.Схемы техники «Кирпичный стежок» и объемного шаблона плетения тигра представлены на фото ниже. Для изготовления поделки понадобятся следующие материалы и инструменты: леска или белая нить, тонкая игла и бусины оранжевого, желтого, коричневого, черного, белого и зеленого цветов. Для брелока можно взять одну красивую крупную бусину. Учтите, что одной длины лески вам не хватит, поэтому придется ее делать.
Звери из бисера в технике «Brick Stitch» сделаны очень просто.Работа начинается с плетения центрального ряда. Внимательно следите за схемой, чтобы рисунок получился ровным и симметричным. Когда вы летите на лицевой поделке, закрепите леску, чтобы тигр не заблокировался. Затем переходите к спине, которой нужен хвост. Оберните кроль с помощью нитки или лески и принесите с ватой. Подобные зверюшки из бусин (объемные) помогут вам соорудить не только тигра, но и других четвероногих друзей. Поэкспериментируйте с цветовым решением и по желанию сделайте белого или черного тигра, который поразит своей оригинальностью.Если вы новичок в этой технике, ознакомьтесь с правилами плетения перед началом работы, чтобы изделие получилось правильным.
«Кирпичная строчка» для изготовления объемного тигра
Эта техника одна из самых простых, и в результате получаются отличные зверюшки из бисера. Для новичков схемы составлены так, чтобы они могли правильно понять принцип плетения. Первый ряд — это основа, на которой будет держаться все изделие. Положите на леску две бусинки и пропустите второй конец лески через второй конец; Далее необходимо прокатить одну бусину и таким же образом закрепить.Следующий этап не менее ответственный. Для плетения второго и последующих рядов необходимо надеть рыболовную иглу, которая облегчит задачу. Наглядная схема демонстрирует, как происходит плетение.
Фантазия Зверушки
Если вы не освоили ни одной техники плетения из бисера, но очень хотите сделать из этого материала кота или другое животное — взгляните на свою другую сторону. Вам не нужно брать в руки иглу с леской, а главное — у вас будет гораздо меньше времени на реализацию своей идеи.Животных из бисера плести не обязательно — фигурки можно выложить на ткань или любой другой материал в виде мозаики. Цвет и размер материалов значения не имеют, ведь фантастические животные — плод вашей фантазии. На фото узор кошки выложен крупными продолговатыми и круглыми бусинами. Следует взять темную ткань (на ней фигура будет смотреться эффектнее) и мелом под контур животных. Залейте выложенный участок клеем или пластилином, выложите на него заготовленные материалы.Если вы, не обладая навыками вышивки бисером, когда-нибудь задумаетесь о том, как сделать звериные бусы, смело берите в руки самые примитивные материалы и выкладывайте этого чудесного и яркого кота. Даже если сразу не получается сделать все красиво и аккуратно — не расстраивайтесь. Немного восприимчивых и терпения — и вам непременно захочется и дальше заниматься этим ремеслом.
Объемные фигурки из бисера — занятие увлекательное. При первом знакомстве со схемами объемных фигур кажется, что составить фигурки — задача непростая, но спешим ее заверить.Один совет — Для придания устойчивости рекомендуем использовать тонкую проволоку.
В последнее время особую популярность среди рукодельниц и мастериц приобрело вышивание бисером. Это модное рукоделие дает множество возможностей для создания красивых и необычных поделок своими руками. Изделия из бисера не только красивы, но и разнообразны. Фигурки пользуются особой популярностью, ведь они олицетворяют ласку, покой, уют и доброту.
Бусины бывают двух видов: плоские и объемные.Объемная вышивка бисером сложнее плоской, но изделие интереснее. Такое рукоделие позволяет развить мелкую моторику и творческое мышление.
Для плетения объемного зверька из бисера (в данном случае кота) нам понадобится проволока (желательно яркая, так как темнота будет выделяться на белой бусине и портить вид), бусины черного и белого цвета , а также несколько бусинок красного (для рта), зеленого (для глаз), серого (для хвоста) цветов, а также более крупной бусинки розового цвета для носа.
Путем параллельного плетения по предложенной выше схеме. Начинаем плести с носика, заканчиваем хвостик.
При желании можно выполнить объемное животное из бусинок побольше, например коттвонг, если увеличить схему пропорционально этому размеру.
Пополним коллекцию котят таким милым, забавным котенком из бисера. Мастер-класс поможет вам освоить технику объемного плетения бисера. Значительно упрощает работу программа, что наглядно продемонстрирует в схематическом виде весь процесс работы.Именно этот мастер-класс отлично подойдет тем, кто только начинает осваивать этот вид работы, и уже тем, у кого есть опыт.
Для работы нам потребуются:
- проволока диаметром 0,3 мм
- коричневый, белый, оранжевый, розовый и зеленый бисер 2,5 мм
- леск
Приступаем к работе, сначала необходимо отрезать кусок проволоки, длина его должна быть два метра. Сначала нужно сплести одну большую деталь — голову, затем туловище, после хвоста котенку.После этого можно начинать плести ушки, лапки, которые делаются отдельно.
Плач по схеме
Начинаем с головы котенка, не забываем, что при плетении вставляем две бусинки розового цвета для пасти, а для глаз нужно вставить еще две зеленые бисера. Берем два небольших отрезка проволоки для ушей и делаем треугольник. Для того, чтобы ушки крепились на голове, нужно протянуть концы проволоки через бусинки головных рядов.
Теперь делаем лапы кошачьи, для этого берем четыре отрезка проволоки большого размера и делаем их по схеме, также по показанной схеме, крепим лапы к туловищу. Переходим к дизайну мордочки котенка, а именно делаем глазки. Возьмите черную краску и нарисуйте зрачки на каждом зеленом. Продев мордочку сквозь бусинки небольшими кусочками лески, получатся такие усы. Этого кота можно использовать не только в качестве декора, но и сделать брелок или подвеску на рюкзак или сумку.
Подготовить к работе:
- бус
- леск (примерно 4 м)
- проволока
- бусина (диаметр 15-20 мм, устанем)
Плетем сетку тремя бисеринками шириной 2,5 ромба.
Когда половина обхвата большой бусины будет готова для лески, ее необходимо закрепить (на красной линии на схеме). В этом случае, когда мы соединим сетку в кольцо, работа не растечется.Не обрезайте леску!
Теперь наматываем на катушку еще 1-1,5 метра лески и промазываем вторую половину сетки. В процессе работы не забывайте примерять сетку к бусинке. Он должен растянуть по плотности.
Перед тем, как соединить сетку в кольцо, оба конца лески должны быть с одной стороны. Пока не трогайте соединение. Выполняется тем же концом лески, на который мы выбрали 2-ю половину работы.
Разводим концы лески в разные стороны, продавая в пивке.
Отсутствующие бусины с мозаикой. Можно по очереди плести с каждой стороны, чтобы сетка не сползла.
Здесь длина сетки 14 ромбиков, 4 ряда плетения без поднятия, 6 бисперов убрали в 5 рядах и еще 4 штучки убрали.
Морда
Объемная вышивка бисером совсем не сложна, если внимательно изучить схему.Мы продолжим. На фото звездочками отмечены места крепления бульонов и носика. Тут надо два-три раза прошить, но не туго, выходим из розового напитка и стягиваем двумя стежками до самой основы.
Выковыриваем глазки.
На этом этапе морда оставлена. Подойдите к коту с конца.
Подносим иглу к месту прикрепления хвоста.
Переход к ушам.
Когда уши готовы, кончик лески фиксируется и срезается.Если лапки будут от лески — оставляем так.
Лапы
Находим ось симметрии. Выбираем бусинки, к которым будем пристегивать лапы.
Для скрепления проводим через 2-3 биспера. Выходим из бусинки из лап.
Делаем лапки из лески в два прохода — на втором пропускаем к белому бисеру ближайший к белому бисер. Необходимо, чтобы кошка стояла на полную ногу.
Лапы готовы.
Усы
Намотываем леску 10-15 см. Связываем пеленку в средний узел.
Немного крючком протянуть петли горничной между носом и дешёвкой снизу вверх с каждой стороны. Один наконечник нужно пропустить через основание основы или носа и связать со вторым наконечником, затем заполнить погружной. Настоящие усы.
на этом урок объемного бисероплетения завершен.Наш кот готов!
Сегодня мы предлагаем вам схему плетения брелков — объемных фигурок из бисера, кота и пантеры. Схема прилагается.
В данном случае мы видим, как выглядит Пантера.
Далее описывается, как делать шары на основе колец и 4 бусины, потому что этот метод используется в технике плетения наших фигур.
Мяч выполняется за один конец проволоки или лески, без основы. Форма набора мяча показана на рисунке 111.В плетении используем бусинки с крупными отверстиями.
Набираем на леску 4 биспера и, замыкая их в кольцо, скрещиваем оба конца (рабочий и не рабочий) в несущей. Как это сделать, показано на рисунке 112 а. Узел на конце не завязывается. Оставляем хвост длиной 6-7 см.
Набираем 3 бисерины и замыкаем в кольцо, проводим конец лески в 7 бисерин и 2 кольца-основы. См. Рисунок 112 b. Набираем 2 бисера и замыкаем их в следующее кольцо, пропускаем кончик лески к беринке 5 предыдущего кольца сверху вниз и в бисеринки 2 и 3 основного кольца (см. Рис. 112 V).
Таким же образом проводим еще одно кольцо, проводя леску 8, 3 и 4, а затем — в беринку 7 первого кольца снизу вверх (рисунок 112 г).
Набираем 1 бисеринку на леску и пропускаем ее кончик в бисеринки 10, 4, 7 (см. Рисунок 112 D). Теперь мяч надо стесняться, он обретет объемную форму. Для этого продеваем конец лески через бисперы 6, 9, 11, 12. Леска туго туго. Для завершения работы протяните линию бусинки 7 сверху вниз (см. Рисунок 112 E).
Далее завязываем узел на леске рабочего и нерабочих концов, концы лески обрезаем и платим. Получился шар из трех вертикальных рядов бисерины, в каждом ряду — по 4 бисерины. Итого — 12 (см. Рисунок 113).
Вот что мы сделали:
Подбираем игрушечную тряпочку. Складываем вдвое и вырезаем. Ниже на схеме указано, какие детали и как вырезать.
Схема
Детали головы пришиваем, головку прикручиваем ватой, прошиваем дырочку.У основания каждого ушка сделайте небольшую складку и пришейте ушки. Отправьте носик, глазки, вышейте ротик, сделайте из ниток усы.
Теперь вы подготовите каркас, как показано на схеме ниже. Для этого нужно взять 3 отрезка проволоки нужной длины, скрутить их вместе в центре. Делаем так, чтобы одна из наших проволок стала шеей, переходящей в хвост, две другие — ногами.
Оборачиваю тело кота ватой и нитками. Нанесите на спину кошки отделку для тела, прежде чем сделать небольшие надрезы на шее и хвосте.Брюшко зашиваем на время. Спереди и за обшивкой опускаемся внутрь и пришиваем так, чтобы не было видно края.
Едем на шее, лапках и бусах хвоста. Примените наш фреймворк к нашему фреймворку. Ножки собираем на нитке, швом используем «через край». На спине кошки делаем отверстие, в него вставляем шейную петлю. Зашиваем дырочку.
Схема в данной модели игрушки отсутствует, но принцип плетения будет представлен ниже с подробным описанием.
Нам понадобится бусинка для туловища кошки — серая или черная, белая для оборок, лап и живота и красная для носа, вата, проволока для основы, мононить и «пластик» для основы.
Изобретательность всегда приветствуется. Поэтому этот рисунок сделан автором … жевательной резинки.
Плетение начинается с лица.
Используется прямое плетение или мозаика. Вы можете вышить другим цветом пятна или полосы на шкуре кошки.Внести изменения можно с помощью бусинки большего размера, все зависит от вашей фантазии.
Лапки и хвостик выполнен в технике мозаичной сбруи, шьем отдельно.
Посмотрите на кота с разных сторон, так станет понятна техника плетения.
Наша объемная игрушка из бисера готова!
Подготавливаем набор необходимых аксессуаров:
- basad Basic Color (Golden)
- под цвет румба и лапки серебряные бусины
- на глазки зеленые
- на нос и рот розово-красный бусины
- для создания туловища один большой шарик
- для головы, шарик чуть меньше, чем для тела
- для хвоста и лап проволока
- леске для ушей
- инструменты для вышивки бисером
- бусины
Сначала сделаем туловище кота.Для этого нужно раскрасить в тон основного цвета большой шар, которым будет кот. Оставить при этом только не крашеный белый окунь. Вы можете выбрать мяч желаемого цвета для работы.
После высыхания краска продолжает работу. По всей окружности шара начинаем плести цепочку на бусинах ниток. Для удобства закрепляем шарик поделками, после этого продолжаем плетение, постоянно увеличивая, они незабываемы, что нам нужно вставить серебряные бусины, делая животик коттедж.
Когда ряд по окружности шара будет широким, начинаем подписываться с бусинки.
Теперь приступаем к изготовлению хвоста и лапки. Для этого берем небольшой отрезок проволоки и складываем пополам.
На проволоку из проволоки наносим бусину в цвет основного цвета кота. Прокатываем бусинки до половины проволоки, затем наносим немного бисперина серебристого цвета и снова золотистого. Должно со временем получиться такое же количество бисера, теперь проволоку согните пополам и затяните.Так сделайте все остальные лапы.
Самый длинный кусок проволоки будет для хвоста, плести его точно так же, как лапы. С помощью кончиков шерсти лап и хвоста закрепите их на туловище кошки. Пропускаем проволоку через пиво в предполагаемом месте, а оставшуюся проволоку скручиваем вокруг проволоки. Отрежьте оставшуюся или прикрутив лапу, соблюдайте симметрию.
Теперь делаем голову кошки, для этого берем мяч, который мы приготовили заранее.Если не получилось, можно просто взять кусок фольги и скатать, сделав шар диаметром чуть меньше тела кошки. Мяч расписан под основной цвет кота акриловой краской.
Зафиксируем, пропустив иглу шарика с леской, и начнем набухать головные бусинки. Начинаем со слабого, как тело, ремня. В качестве завершающего этапа создайте симпатичную мордочку кота.
Берем две бусинки зеленого цвета и симметрично пришиваем их поодиночке рядом с другой.Нос и рот с шелушащимися бусинками с розовыми бусинками.
Для ушей создаем угол из проволоки и катаем по нему бусинки, можно сделать им любую форму по желанию. Для усов используем леску, которую пропускаем через мордочку на месте носика.
Осталось закрепить голову к туловищу, а потому на один из двух шариков вставляем один ряд с бусинками с бусинками, так формируем шею. Затем пришиваешь голову к туловищу и плотно затягиваешь все нити.Для декора можно сделать бантик и прикрепить дачу из любой тесьмы. Теперь кот готов.
Чтобы выполнить такую объемную игрушку из бусинки в виде красивого кота, нам понадобятся: бусинки двух цветов — по цвету и на животик и на ножку. Красные бусины на сердечке. Совсем немного бусинок для рта, глаз и носа, а также шарик (для настольного тенниса). Леск, проволока. Бусинки на лапках и хвосте (утолщение) и ушки (помадка).
Мяч раскрашиваем под цвет кошки и оставляем кружок под животиком.№
Раскрашенным шариком сплетите перекрещенную цепочку по его окружности. Мяч должен проткнуть крестик, чтобы тесьма не скользила по нему.
Мы взбиваем полосу с двух сторон от белого пролета таким образом, как показано на фото. Когда ряд становится слишком широким — убавляем (две бисеринки сплетаем как одну).
Возьмите плетеный мяч. Это тело кота.
Далее займемся иголкой и лапками. На сложенную пополам проволоку надеть бусину и скрутить, оставив кусочки по 2-3 см.Сделайте 5 заготовок. Самый длинный — у хвоста. Самый короткий для передних лап.
Прикрепите хвост и лапы к туловищу кошки таким образом: переверните бусинку, закрутите и снимите кончик (прикус). Можно не кусать, а просто укутывать.
Теперь лапы и хвост оставить. Делаем это мозаичной обвязкой. В данном случае по 5 бусинок по 3 бусинки в центре.
Когда дойдете до бусинки — до края жгута снять крестовину с добавлением.После этого портим сам бусинку. Таким образом делаем все лапки и хвостик. Для головы берем фольгу, скатываем в шар. Ухудшаем так же, как был приведен в действие шар. На месте грани оценок делать не нужно.
Сердечко делаем так: крестиком в форме сердца режем крестиком, делаем таких 2 штуки. Расчет — крест 5х3. Далее перекрещиваем крест, вставляем внутрь бусинки и все это нужно пришить к кошачьим лапкам.
Делаем мордочку: проушины пришиты.Носик и мордочка должны быть входами между бусинками нашей косы. Делаем ушки и усы.
Наклоните голову вперед к туловищу.
Закрепите леску с помощью иглы.
Объемная игрушка из бусинок готова. Симпатичный котик, который не стыдно подарить.
Для объемных фигурок, например белого бусиного кота, используется леска или проволока, изделие лучше получается на леске. При объемной вышивке указанная на схеме сумма набирается в замкнутое кольцо, а затем добавляются новые ряды.
Две иглы набирают цепочку из 14 пар пива (рис. 1), замыкая цепочку в кольцо, соединяя начало и конец. Обе иглы выводятся в одном направлении, через пары колец, расположенных напротив сустава. Сплетите еще одну цепочку из 6 пар пива. Получился каркас кошачьей головы. Полностью голову делаем по схеме №2.
Уши на рисунке 3, приподнятые до основания головы в месте, указанном на рисунке 4.Исходя из этого, головы с ушками нужно произвести дополнительную заливку, имитируя шерсть (рис. 5). Закрепите 3 бусинки носик ёжика, сделайте глазки и прикрепите носик. Плетем усы из мелких жемчужных бусинок — по 8, 8 и 6 бусинок в каждом усе Кошки (рис. 6).
Изготовление разнообразных животных из бисера — популярное хобби, ведь такие поделки смотрятся красиво и интересно. К тому же такое рукоделие идеально подходит для детей и подростков. Плоские или сыпучие изделия можно использовать как игрушки для маленьких детей, брелоки, подарки и сувениры.Рассмотрим схемы плетения объемных игрушек зверюшек из бисера.
Фигурки из бисера для начинающих
Вышивка бисером — это творчество, развитие воображения, мелкой моторики, терпения и ловкости. С его помощью можно делать как объемные, так и плоские легкие формы. Необычное украшение для телефона, рюкзака или рабочего стола можно вышить бисером из бабочек и всевозможных животных, которые легко сделать, используя схемы.
Плетение дельфина.
Дельфин, сделанный из резины или бусинки, может украсить интерьер, стать игрушкой для ребенка, подарком или брелком для сумки, ключей.Желательно выбирать леску, которая плотно затягивается и не ломается, или использовать проволоку.
Необходимые материалы:
- Леске.
- Проволока тонкая — для формирования ребер.
- Ножницы.
- Схема.
- Чёрные, синие и синие бусины.
Инструкция:
Засыпаем бусинки в лоток и раскладываем схему перед глазами. Отрезаем большой кусок лески и начинаем плести от носика, следуя схеме.Чтобы самолет получился объемным, каждый слой требуется дважды. Выпить по одной бусине за брюшко зверька и макушку. Повторите первый слой в обратном порядке. В получившихся двух бусинках необходимо вывернуть второй конец лески и протянуть до конца. Аналогичным образом будет сделана вся фигура.
Продолжаем носить две бусы по схеме. Второй конец превратить в стакан и затянуть. Продолжайте определять схему перед хвостом. Для того, чтобы выполнить хвост зверька, нужно набрать на один конец лески 6 синих бисперов.Чтобы повернуть еще 2, введите в предпоследнюю леску и затяните к туловищу. Потом снова прокатимся на 6 голубых бусинах. Чтобы закончить хвост, нужно повернуть линию в слое, где начинался хвост. Таким же образом сделайте вторую часть. Далее по лопаточной схеме плавников. Возьмите небольшой кусок проволоки. С конца плавника забейте бусинки и плейте так же, как и туловище. Наконец, прикрепите к дельфину плавники.
Черепаха и крокодил
Для изготовления красивой черепахи вам понадобятся:
- Леске и проволока.
- Бусины черного, оливкового, ярко-зеленого и белого цветов.
Создание животного для начала с хвоста. Для этого вырежьте 1 метр лески и вбейте в него одну светлую пивку, затем еще две, чтобы повернуть леску. Далее переходим к следующему ряду: ездим на трех светлых стеклах, поворачиваем леску и затягиваем. Продолжайте определять все тело животного, а в конце делать узел. По схеме лопаты и прикрепляем к туловищу: по две — возле головы и хвоста.
Для создания крокодила необходимы бусинки: Салат — для животика, зеленый — для спины, черный — для глаз.
Отрежьте проволоку 30 см, чтобы сделать нижнюю челюсть, и 180 см — для тела.
Пошаговая инструкция:
Берем длинную проволоку и начинаем плести от хвоста. Надрезать три зеленых и три салатных бусинки и пропустить их через последние края проволоки, затянуть. Продолжайте плести так, чтобы зеленый слой оказался поверх салата. Затем прокатите три ряда по три бисеринки и пропустите ряд из 9 бисеринок. После этого проехать 10 зеленых и повернуть конец.
Для создания лапки носить 7 бусинок на свободные кончики, пропустить крайние 3 и перевернуть оставшиеся 4.Когда лапки сделаны, натяните нижний толщинный слой из 10 стаканов. Сделать 5 рядов до 10. На последнем слое плести лапки. Завершение ряда, состоящего из 8 бисеринок, вставить в нижний слой проволоки для нижней челюсти. Обработайте верхнюю и нижнюю часть челюстей и закрепите концы. Все, товар готов.
Объемная обезьянка и лягушка
Забавная обезьянка может стать подарком ребенку или другу. Объемная схема Зверька предполагает использование параллельного плетения. №
Для изготовления зверька понадобятся: бусина темного цвета — для имитации шерсти, светлая — для ушей, бровей, мордашки, бусинка большего диаметра — для носа.
Пошаговая инструкция:
Отрежьте проволоку длиной 90 см и начните нарушать первый ряд, в том числе 7 бисерин. Концы проволоки растяните, образуя кольцо — это будет выступ. Составьте следующий ряд, состоящий из трех бисеринок. Затем сплести ту часть лица, где будет носик. Поднесите стакан так, чтобы посередине была большая бусинка. Нижний ряд состоит из 7 зерен, в верхнем ряду учитывается глаз. В следующем ряду провести ушки обезьяны.Затем сделайте туловище, продев в местах будущих ног зверюгу лишнюю проволоку. По завершению окончания туловища, плечевые части ног 9 парными рядами по 4 биспера.
Лапу сделать плоской: первый ряд — 2 стакана, второй — 3, третий — 4. После этого пальцы и животное готовы.
Для плетения лягушек понадобятся бусины черного, зеленого, красного и желтого цветов.
Прогресс:
Таким образом, с помощью схем плетения объемных зверушек из бисера можно сделать красивые поделки, которые смогут не только украсить комнату, но и стать прекрасным подарком близким людям.
Плетение фигурок животных из бисера
% PDF-1.4 % 2538 0 объект > эндобдж xref 2538 97 0000000016 00000 н. 0000002314 00000 н. 0000002506 00000 н. 0000002659 00000 н. 0000008288 00000 н. 0000008450 00000 н. 0000008537 00000 н. 0000008630 00000 н. 0000008725 00000 н. 0000008907 00000 н. 0000008978 00000 н. 0000009086 00000 н. 0000009201 00000 п. 0000009403 00000 п. 0000009474 00000 н. 0000009571 00000 н. 0000009669 00000 н. 0000009892 00000 н. 0000009962 00000 н. 0000010075 00000 п. 0000010213 00000 п. 0000010452 00000 п. 0000010522 00000 п. 0000010623 00000 п. 0000010721 00000 п. 0000010886 00000 п. 0000010956 00000 п. 0000011070 00000 п. 0000011188 00000 п. 0000011295 00000 п. 0000011364 00000 п. 0000011477 00000 п. 0000011546 00000 п. 0000011660 00000 п. 0000011729 00000 п. 0000011845 00000 п. 0000011914 00000 п. 0000012028 00000 п. 0000012097 00000 п. 0000012213 00000 п. 0000012282 00000 п. 0000012389 00000 п. 0000012458 00000 п. 0000012526 00000 п. 0000012674 00000 п. 0000012744 00000 п. 0000012814 00000 п. 0000012883 00000 п. 0000013047 00000 п. 0000013117 00000 п. 0000013174 00000 п. 0000013332 00000 п. 0000013389 00000 п. 0000013459 00000 п. 0000013601 00000 п. 0000013671 00000 п. 0000013741 00000 п. 0000013896 00000 п. 0000013966 00000 п. 0000014112 00000 п. 0000014182 00000 п. 0000014252 00000 п. 0000014365 00000 п. 0000014436 00000 п. 0000014546 00000 п. 0000014617 00000 п. 0000014735 00000 п. 0000014805 00000 п. 0000014924 00000 п. 0000014994 00000 п. 0000015116 00000 п. 0000015186 00000 п. 0000015256 00000 п.